Butan Keplete
A Bután Képlete: Mélyreható Kémiai És Gyakorlati Elemzés
Ebben a kimerítő cikkben részletesen feltárjuk a bután kémiai képletét, szerkezetét, tulajdonságait és gyakorlati alkalmazásait. Célunk, hogy egy átfogó képet nyújtsunk erről a fontos szénhidrogénről, amely számos ipari és háztartási területen nélkülözhetetlen.
A Bután Alapvető Kémiai Képlete és Szerkezete
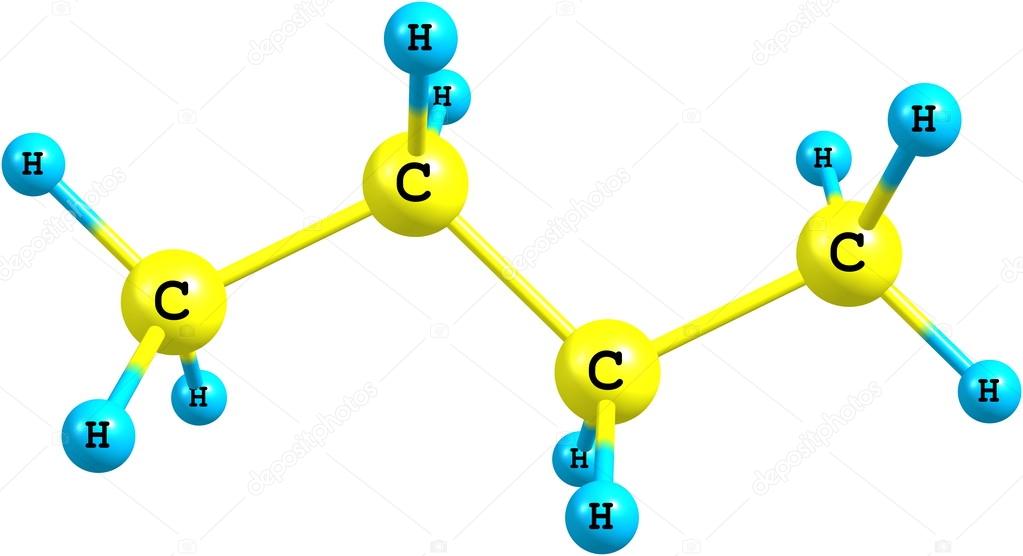
A Bután Molekulaképlete: C₄H₁₀
A bután molekulaképlete C₄H₁₀, ami azt jelenti, hogy minden egyes butánmolekula négy szénatomból (C) és tíz hidrogénatomból (H) épül fel. Ez a képlet önmagában is sok információt hordoz a molekula összetételéről.
A Bután Szerkezeti Képletei
A molekulaképlet mellett fontos megérteni a bután szerkezeti képleteit is, amelyek megmutatják az atomok közötti kapcsolódásokat. A butánnak két fő izomerje létezik:
n-bután (normál bután)
Az n-butánban a négy szénatom egyenes láncot alkot. A szerkezeti képlete így ábrázolható:
CH₃-CH₂-CH₂-CH₃
Ez azt jelenti, hogy az első és a negyedik szénatomhoz három-három hidrogénatom kapcsolódik, míg a második és a harmadik szénatomhoz kettő-kettő.
izobután (2-metilpropán)
Az izobutánban a szénatomok elágazó láncot alkotnak. A szerkezeti képlete a következő:
(CH₃)₃CH
Ez azt jelenti, hogy egy központi szénatomhoz három metilcsoport (-CH₃) és egy hidrogénatom kapcsolódik.
A Kötések Jellege a Butánban
A bután molekulájában a szénatomok közötti és a szén- és hidrogénatomok közötti kötések kovalens kötések. Ezek a kötések erősek, ami hozzájárul a bután viszonylag stabil molekulaszerkezetéhez.
A Bután Főbb Fizikai Tulajdonságai
Halmazállapot és Szín
Szobahőmérsékleten és normál légköri nyomáson a bután színtelen, szagtalan gáz. Magasabb nyomáson vagy alacsonyabb hőmérsékleten folyékonnyá válik.

Forráspont és Olvadáspont
Az n-bután forráspontja körülbelül -0.5 °C, olvadáspontja pedig -138 °C. Az izobután forráspontja valamivel alacsonyabb, körülbelül -11.7 °C, olvadáspontja pedig -159.6 °C.
Sűrűség
A bután gáz sűrűsége alacsonyabb a levegőnél, ezért szivárgás esetén a föld közelében terjed.
Oldhatóság
A bután vízben rosszul oldódik, de jól oldódik apoláris oldószerekben, például más szénhidrogénekben.
A Bután Kémiai Tulajdonságai és Reakciói
Égés
A bután egy gyúlékony gáz, amely oxigénnel reagálva ég. A tökéletes égés során szén-dioxid és víz keletkezik, valamint jelentős mennyiségű hő szabadul fel:
2 C₄H₁₀ + 13 O₂ → 8 CO₂ + 10 H₂O + hő
Ez a reakció teszi a butánt kiváló tüzelőanyaggá.
Halogénezés
A bután halogénekkel, például klórral vagy brómmal szubsztitúciós reakcióba léphet fény vagy hő hatására. Ezek a reakciók komplex termékkeveréket eredményezhetnek.
Krakkolás
Magas hőmérsékleten és katalizátorok jelenlétében a bután kisebb szénhidrogénekre bomolhat (krakkolás). Ez az eljárás fontos a petrolkémiai iparban.
A Bután Előállítása
Kőolaj-finomítás
A bután főként a kőolaj-finomítás melléktermékeként keletkezik. A kőolaj desztillációja során a különböző forráspontú szénhidrogének elkülönülnek, és a bután a könnyebb frakciók között található meg.
Földgáz-feldolgozás
A bután kisebb mennyiségben a földgázban is megtalálható, és a földgáz feldolgozása során nyerhető ki.
A Bután Felhasználási Területei
Tüzelőanyag

A bután széles körben használt tüzelőanyag. Folyékony propán-bután (LPG) keverékek formájában háztartási fűtésre, főzésre és gépjárművek meghajtására használják.

Hajtógáz
A butánt aeroszolokban hajtógázként is alkalmazzák, például dezodorokban, hajlakkokban és festékszórókban.
Hűtőközeg
Bizonyos hűtőberendezésekben a butánt hűtőközegként használják, különösen olyan alkalmazásokban, ahol a környezetvédelmi szempontok fontosak.
Petrolkémiai alapanyag
A bután fontos alapanyag a petrolkémiai ipar számára. Felhasználják más vegyületek, például butadién előállítására.
Oldószer
A butánt extrakciós eljárásokban oldószerként is alkalmazzák.
A Bután Biztonsági Tudnivalói
Gyúlékonyság
A bután rendkívül gyúlékony gáz. Nyílt lángtól és gyújtóforrásoktól távol kell tartani. Szivárgás esetén robbanásveszélyes lehet.
Fulladásveszély
Nagy koncentrációban a bután a levegő oxigénjét kiszoríthatja, ami fulladáshoz vezethet. Gondoskodni kell a megfelelő szellőzésről zárt térben történő használat esetén.
Kezelés és Tárolás
A butánt nyomásálló tartályokban kell tárolni, hűvös, jól szellőző helyen, távol hőforrásoktól és gyújtóforrásoktól. A tartályokat óvatosan kell kezelni, elkerülve az ütéseket és sérüléseket.
A Bután Izomerjei Részletesen
Az n-bután részletes jellemzése
Az n-bután, más néven normál bután, egy lineáris szerkezetű alkán. Négy szénatomja egymáshoz kapcsolódik egyenes láncban. Minden szénatomhoz a megfelelő számú hidrogénatom kapcsolódik, hogy a szén négy vegyértéke telítődjön. Az n-bután molekulaképlete C₄H₁₀, és szerkezeti képlete CH₃-CH₂-CH₂-CH₃. Fizikai tulajdonságai közé tartozik a -0.5 °C-os forráspont és a -138 °C-os olvadáspont. Színtelen és szagtalan gáz, de gyakran szagosító anyagokat adnak hozzá a szivárgás észlelése érdekében. Kémiailag az n-bután az alkánokra jellemző reakciókat mutatja, mint például az égés és a halogénezés.
Az izobután (2-metilpropán) részletes jellemzése
Az izobután, más néven 2-metilpropán, a bután egy elágazó láncú izomerje. Három szénatom egy propánvázat alkot, amelynek a második szénatomjához egy metilcsoport kapcsolódik. Molekulaképlete szintén C₄H₁₀, de szerkezeti képlete (CH₃)₃CH. Az izobután forráspontja alacsonyabb, körülbelül -11.7 °C, olvadáspontja pedig -159.6 °C. Fizikai és kémiai tulajdonságai némileg eltérnek az n-butánétól a szerkezeti különbségek miatt. Az izobutánt is széles körben használják tüzelőanyagként és hajtógázként.
Az izoméria jelentősége
Az a tény, hogy a butánnak két stabil izomerje létezik, jól szemlélteti az izoméria fogalmát a szerves kémiában. Az izomerek olyan vegyületek, amelyeknek ugyanaz a molekulaképletük, de eltérő a szerkezeti képletük, és emiatt eltérő fizikai és kémiai tulajdonságokkal rendelkezhetnek. Az n-bután és az izobután közötti különbségek befolyásolják forráspontjukat, olvadáspontjukat és reakcióképességüket is.
A Bután a Mindennapi Életben
Butángáz a háztartásokban
A butánt gyakran használják háztartási célokra folyékony formában, gázpalackokban. Ezeket a palackokat használják főzéshez (gáztűzhelyek), fűtéshez (hordozható gázkályhák) és kempingezéshez (gázfőzők, gázlámpák). A bután tiszta égése és magas fűtőértéke miatt népszerű választás a háztartásokban.
LPG (Liquefied Petroleum Gas)
A kereskedelmi forgalomban kapható gázpalackok gyakran nem tiszta butánt, hanem propán és bután keverékét tartalmazzák, amelyet LPG-nek neveznek. A keverék aránya az évszaktól és a felhasználási céltól függően változhat. A propán alacsonyabb forráspontja miatt hidegebb időben nagyobb arányban van jelen, hogy biztosítsa a gáz elpárolgását.

Bután a hajtógázokban
A butánt széles körben alkalmazzák hajtógázként aeroszolos termékekben. Nem mérgező, nem korrozív és jól elegyedik más összetevőkkel. A bután segít a termék finom eloszlatásában spray formájában. Ilyen termékek például a dezodorok, hajlakkok, festékszórók és tisztítószerek.
Bután a hűtőiparban
Bár korábban más freon típusú vegyületek voltak elterjedtek, a butánt és izobutánt egyre gyakrabban használják hűtőközegként háztartási hűtőszekrényekben és fagyasztókban. Környezetbarátabb alternatívát jelentenek, mivel ózonkárosító hatásuk elhanyagolható.
A Bután Kémiai Reakciói Mélyebben
A tökéletes és tökéletlen égés
Mint korábban említettük, a bután tökéletes égése során szén-dioxid és víz keletkezik. Azonban, ha nem áll rendelkezésre elegendő oxigén, tökéletlen égés következik be, amelynek során szén-monoxid (egy mérgező gáz) és korom (elemi szén) is keletkezhet:
2 C₄H₁₀ + 9 O₂ → 8 CO + 10 H₂O
C₄H₁₀ + 5 O₂ → 4 C + 5 H₂O
A tökéletlen égés elkerülése érdekében biztosítani kell a megfelelő levegőellátást a butánnal működő berendezésekben.

Szubsztitúciós reakciók halogénekkel
A bután alkánként szubsztitúciós reakciókba léphet halogénekkel, például klórral (Cl₂) vagy brómmal (Br₂). Ezek a reakciók fény vagy hő hatására indulnak meg, és a hidrogénatomokat halogénatomok helyettesítik. A reakciók lépésekben mennek végbe, és többféle halogénezett termék keletkezhet. Például a klórozás során monoklórozott, diklórozott stb. butánszármazékok jöhetnek létre.
Katalitikus reformálás
A petrolkémiai iparban a butánt katalitikus reformálási eljárásokban is felhasználják, ahol magasabb oktánszámú benzin komponenseket állítanak elő. Ezekben a folyamatokban a bután izomerizálódhat (n-butánból izobután keletkezhet) vagy nagyobb molekulákká alakulhat át.
A Bután Környezeti Hatásai
Üvegházhatás
A bután önmagában nem tartozik a jelentős üvegházhatású gázok közé. Égése során szén-dioxid keletkezik, ami egy üvegházhatású gáz, de a bután elégetéséből származó szén-dioxid mennyisége általában kisebb, mint más fosszilis tüzelőanyagoké.
Ózonkárosító hatás
A butánnak nincs ózonkárosító hatása, ezért előnyben részesítik bizonyos alkalmazásokban az ózonkárosító freonok helyett.
Levegőszennyezés
A bután tökéletlen égésekor keletkező szén-monoxid és korom hozzájárulhat a levegőszennyezéshez. Ezért fontos a hatékony égés biztosítása a butánnal működő eszközökben.