Aktivalt Komplexum
Az Aktivált Komplexum Részletes Tanulmánya
A kémia lenyűgöző világában a reakciók nem csupán azzal kezdődnek és végződnek, hogy a reagensek termékekké alakulnak. Egy láthatatlan, ám annál fontosabb köztes állapot létezik, amelyet aktivált komplexumnak vagy átmeneti állapotnak nevezünk. Ez a pillanatnyi képződmény kulcsfontosságú a kémiai reakciók megértéséhez és irányításához. Ebben a részletes cikkben mélyrehatóan feltárjuk az aktivált komplexum fogalmát, keletkezésének mechanizmusát, tulajdonságait, valamint a kémiai kinetikában és a katalízisben betöltött szerepét.
Mi Az Az Aktivált Komplexum?
Az aktivált komplexum egy instabil, magas energiájú köztes szerkezet, amely a reagensek ütközésekor és az aktiválási energia leküzdése után jön létre. Ez az átmeneti állapot a régi kötések felbomlásának és az új kötések kialakulásának pillanatát képviseli. Rendkívül rövid élettartamú, és azonnal tovább alakul vagy visszaalakul a reagensekké.
Az Aktivált Komplexum Definíciója és Jellemzői
Pontosabban fogalmazva, az aktivált komplexum egy olyan molekuláris konfiguráció, amely a reakciókoordináta mentén a potenciális energiafelület csúcsán helyezkedik el. Ennek a pontnak a legmagasabb az energiája a reagensek és a termékek energiájához képest. Főbb jellemzői közé tartozik az instabilitás, a magas energiaállapot, valamint a részlegesen kialakult és részlegesen felbomlott kémiai kötések jelenléte.
Az Aktivált Komplexum Keletkezésének Mechanizmusa
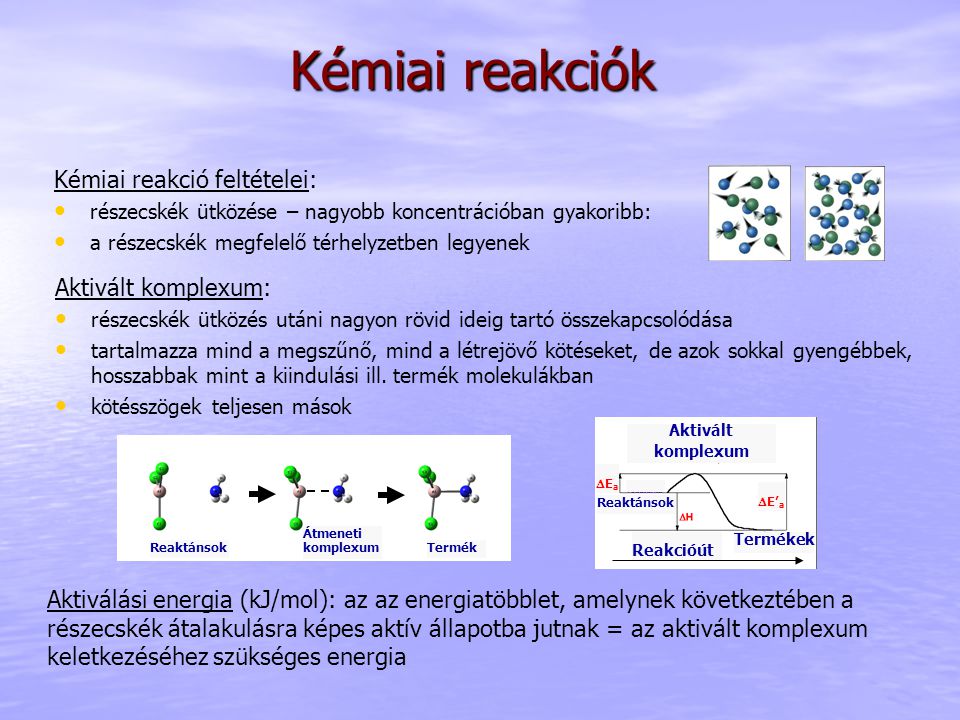
Az aktivált komplexum létrejöttéhez a reagens molekuláknak ütközniük kell egymással, és elegendő kinetikus energiával kell rendelkezniük ahhoz, hogy leküzdjék az aktiválási energiát. Ez az energia szükséges a régi kötések meggyengítéséhez és az új kötések kialakításának megkezdéséhez. Az ütközés megfelelő orientációja szintén elengedhetetlen ahhoz, hogy az aktivált komplexum kialakulhasson.
Az Aktivált Komplexum Tulajdonságai
Az aktivált komplexum számos egyedi tulajdonsággal rendelkezik, amelyek megkülönböztetik a reagensektől és a termékektől.
Instabilitás és Rövid Élettartam
Az aktivált komplexum rendkívül instabil, mivel a potenciális energiafelület csúcsán helyezkedik el. Ez azt jelenti, hogy bármilyen kis energiaváltozás hatására vagy termékekké alakul, vagy visszaalakul a reagensekké. Élettartama rendkívül rövid, tipikusan a femtoszekundum (10^-15 s) nagyságrendjébe esik.
Magas Energiaállapot
Az aktivált komplexum energiája magasabb, mint a reagenseké és általában a termékeké is. Ez a többletenergia az aktiválási energia, amely a reakció beindulásához szükséges. Az aktivált komplexum lényegében egy energiagát tetején helyezkedik el, amelyen a reagenseknek át kell jutniuk ahhoz, hogy termékekké alakulhassanak.
Részlegesen Kialakult és Felbomlott Kötések
Az aktivált komplexumban a reagensek közötti régi kötések részlegesen meggyengültek vagy felbomlottak, míg a termékekben kialakuló új kötések részlegesen létrejöttek. Ez a köztes állapot egyfajta “átmenetet” képez a reagensek és a termékek között, ahol a molekulák szerkezete folyamatosan változik.
Az Aktivált Komplexum Képződésének Elméleti Megközelítései
Számos elméleti modell létezik az aktivált komplexum képződésének és tulajdonságainak leírására.
Az Átmeneti Állapot Elmélete (Transition State Theory – TST)
Az átmeneti állapot elmélete az egyik legfontosabb elméleti keret a kémiai reakciók sebességének magyarázatára. Ez az elmélet feltételezi, hogy a reagensek egy átmeneti állapoton keresztül alakulnak át termékekké, és ez az átmeneti állapot az aktivált komplexumnak felel meg. A TST lehetővé teszi a reakciósebességi állandó kiszámítását az aktivált komplexum tulajdonságai alapján.
Az Átmeneti Állapot Elméletének Alapfeltevései
- A reagensek egyensúlyban vannak az aktivált komplexummal.
- Az aktivált komplexum egyetlen rezgési módja a reakciókoordináta mentén történő bomlás a termékekké.
- A klasszikus mechanika alkalmazható a magok mozgásának leírására az átmeneti állapot közelében.

Az Arrhenius-egyenlet és az Átmeneti Állapot Elmélete
Az átmeneti állapot elmélete szoros kapcsolatban áll az Arrhenius-egyenlettel, amely a reakciósebességi állandó hőmérsékletfüggését írja le. A TST egy részletesebb magyarázatot ad az Arrhenius-féle aktiválási energia és a pre-exponenciális faktor jelentésére molekuláris szinten.
$$\Large k = \frac{k_B T}{h} \frac{Q^\ddagger}{Q_A Q_B} e^{ -E_a/RT}$$
Ahol:
- $k$ a reakciósebességi állandó
- $k_B$ a Boltzmann-állandó
- $T$ a hőmérséklet (Kelvin)
- $h$ a Planck-állandó
- $Q^\ddagger$ az aktivált komplexum partíciós függvénye
- $Q_A$ és $Q_B$ a reagensek partíciós függvényei
- $E_a$ az aktiválási energia
- $R$ az univerzális gázállandó

Az Ütközési Elmélet (Collision Theory)
Az ütközési elmélet egy másik megközelítés a reakciósebességek magyarázatára, különösen gázfázisú reakciók esetén. Ez az elmélet azt feltételezi, hogy a reakciók akkor következnek be, ha a reagens molekulák ütköznek egymással elegendő energiával és megfelelő orientációval. Az aktivált komplexum ebben az elméletben az ütközés pillanatában létrejövő instabil konfigurációnak felel meg.
Az Ütközési Elmélet Főbb Pontjai
- A reakció sebessége arányos az ütközések gyakoriságával.
- Csak azok az ütközések eredményeznek reakciót, amelyekben a molekulák elegendő kinetikus energiával rendelkeznek az aktiválási energia leküzdéséhez.
- Az ütközés geometriája (szterikus faktor) befolyásolja a reakció valószínűségét.
Az Aktivált Komplexum Jelentősége a Kémiai Kinetikában
Az aktivált komplexum fogalma központi szerepet játszik a kémiai kinetikában, a kémiai reakciók sebességének és mechanizmusának tanulmányozásában.
Az Aktiválási Energia Meghatározása
Az aktivált komplexum energiája közvetlenül kapcsolódik az aktiválási energiához. Az aktiválási energia az a minimális energia, amelyre a reagens molekuláknak szükségük van ahhoz, hogy elérjék az aktivált komplexum állapotát és így végbemenjen a reakció. Minél alacsonyabb az aktiválási energia, annál gyorsabban megy végbe a reakció adott hőmérsékleten.
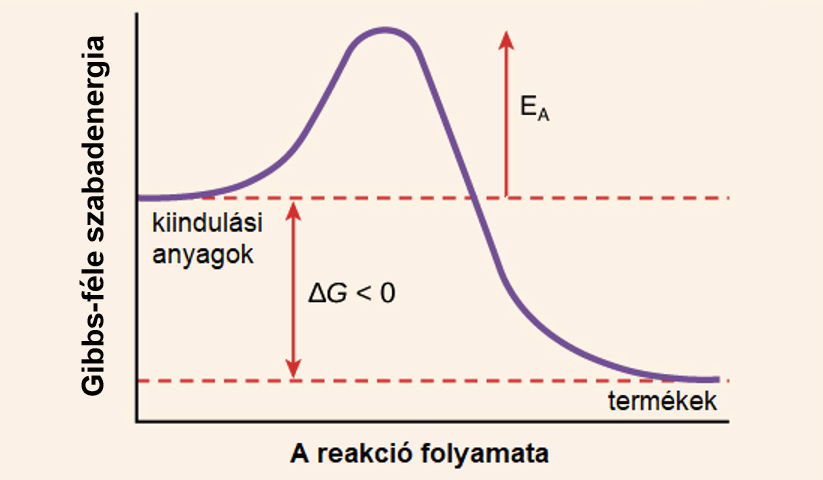
A Reakciósebesség Értelmezése
Az aktivált komplexum létezése és tulajdonságai segítenek megérteni, hogy miért függ a reakciósebesség a hőmérséklettől és a koncentrációtól. A magasabb hőmérséklet több molekulának biztosít elegendő energiát az aktivált komplexum eléréséhez, míg a magasabb koncentráció növeli az ütközések gyakoriságát.
A Reakciómechanizmusok Feltárása
Az aktivált komplexumok tanulmányozása kulcsfontosságú a reakciómechanizmusok feltárásában. A reakciómechanizmus egy részletes lépésről lépésre történő leírása annak, hogy a reagensek hogyan alakulnak át termékekké. Az aktivált komplexumok az egyes elemi lépések átmeneti állapotait képviselik.
Az Aktivált Komplexum Szerepe a Katalízisben
A katalizátorok olyan anyagok, amelyek megnövelik a kémiai reakciók sebességét anélkül, hogy maguk elfogynának a reakció során. Ezt úgy érik el, hogy egy alternatív reakcióutat kínálnak alacsonyabb aktiválási energiával, ami egy alacsonyabb energiájú aktivált komplexum képződéséhez vezet.

Homogén és Heterogén Katalízis
Mind a homogén katalízisben (ahol a katalizátor és a reagensek azonos fázisban vannak), mind a heterogén katalízisben (ahol a katalizátor és a reagensek különböző fázisban vannak), az aktivált komplexum képződése kulcsfontosságú lépés.
A Katalizátor Hatásmechanizmusa
A katalizátor úgy csökkenti az aktiválási energiát, hogy stabilizálja az aktivált komplexumot vagy egy alternatív, alacsonyabb energiájú átmeneti állapotot hoz létre. Ezáltal több reagensmolekula rendelkezik elegendő energiával az aktivált komplexum eléréséhez, ami a reakció sebességének növekedéséhez vezet.
Az Aktivált Komplexum Kísérleti Vizsgálata
Bár az aktivált komplexum rendkívül rövid élettartamú, a tudósok számos kísérleti technikát fejlesztettek ki a tulajdonságainak közvetett vagy közvetlen vizsgálatára.
Gyors Kinetikai Módszerek

A gyors kinetikai módszerek, mint például a villanó fotolízis és a relaxációs technikák, lehetővé teszik a nagyon gyors reakciók és a rövid élettartamú intermedier termékek, köztük az aktivált komplexumok tanulmányozását.
Számítógépes Kémia és Modellezés
A számítógépes kémia és a molekuláris modellezés egyre fontosabb szerepet játszik az aktivált komplexumok szerkezetének és energiájának elméleti leírásában. Különböző kvantumkémiai módszerekkel lehetőség nyílik a potenciális energiafelület feltérképezésére és az átmeneti állapotok azonosítására.
Spektroszkópiai Módszerek
Bizonyos spektroszkópiai módszerek, bár nem közvetlenül az aktivált komplexumot detektálják, információt nyújthatnak a reakcióútvonalról és a köztes termékekről, amelyek segíthetnek az aktivált komplexum tulajdonságainak következtetésében.
Összefoglalás
Az aktivált komplexum a kémiai reakciók megértésének egyik kulcsfogalma. Ez a rövid élettartamú, magas energiájú átmeneti állapot hidat képez a reagensek és a termékek között. Tanulmányozása elengedhetetlen a reakciósebességek, a reakciómechanizmusok és a katalízis megértéséhez. Az átmeneti állapot elmélete és az ütközési elmélet elméleti keretet biztosít az aktivált komplexum tulajdonságainak és szerepének leírásához. A kísérleti és számítógépes módszerek pedig egyre több betekintést nyújtanak ebbe a nehezen megfogható, de annál fontosabb kémiai entitásba.
Aktivált Komplexum: A Jövő Kutatásának Irányai
A jövőbeli kutatások várhatóan még mélyebbre ásnak az aktivált komplexumok dinamikájában és szerkezetében. Az ultragyors spektroszkópiai technikák fejlődése lehetővé teheti az aktivált komplexumok valós idejű megfigyelését. Emellett a számítógépes kémia módszereinek finomodása pontosabb előrejelzéseket tehet lehetővé az aktivált komplexumok tulajdonságaira vonatkozóan, ami új utakat nyithat a katalizátorok tervezésében és a kémiai reakciók optimalizálásában.
Az Aktivált Komplexum Ipari Jelentősége
Az aktivált komplexum megértése nem csupán elméleti jelentőséggel bír. Az ipari kémiai folyamatok optimalizálása szempontjából kritikus fontosságú a reakciósebességek szabályozása és a melléktermékek minimalizálása. A katalizátorok hatékony tervezése, amely az aktivált komplexumok stabilizálásán vagy destabilizálásán alapul, jelentős gazdasági és környezetvédelmi előnyökkel járhat.
Példák Aktivált Komplexumok Előfordulására
Számos kémiai reakcióban az aktivált komplexum központi szerepet játszik. Ide tartoznak például az SN1 és SN2 reakciók az organikus kémiában, ahol egy pentakoordinált átmeneti állapot (az aktivált komplexum) alakul ki. Hasonlóképpen, a fémorganikus katalizált reakciók, mint például a Heck-reakció vagy a Suzuki-kapcsolás, is aktivált komplexumokon keresztül mennek végbe, amelyek szerkezetének és energiájának megértése kulcsfontosságú a katalizátor hatékonyságának növeléséhez.
Az Aktivált Komplexum és a Biokémiai Reakciók
A biokémiai reakciók, amelyek az élő szervezetekben zajlanak, szintén aktivált komplexumokon keresztül mennek végbe. Az enzimek, mint biológiai katalizátorok, rendkívül hatékonyan csökkentik a biokémiai reakciók aktiválási energiáját azáltal, hogy stabilizálják az átmeneti állapotot. Az enzim-szubsztrát komplexus kialakulása és az azt követő átmeneti állapot létrejötte kulcsfontosságú lépés az enzimatikus katalízisben.