Arrhenius Egyenlet
Az Arrhenius-egyenlet részletes elemzése: A reakciósebesség hőmérsékletfüggése
Bevezetés az Arrhenius-egyenlet világába
A kémiai kinetika egyik alapvető egyenlete az Arrhenius-egyenlet, amely megadja a kémiai reakciók sebességi állandójának hőmérséklettől való függését. Svante Arrhenius svéd kémikus fedezte fel ezt az összefüggést 1889-ben, és azóta is a kémiai reakciók sebességének megértésének és előrejelzésének kulcsfontosságú eszköze. Az egyenlet nem csupán egy matematikai formula; mély betekintést nyújt a molekuláris szintű folyamatokba, amelyek egy kémiai reakció lejátszódásához szükségesek. Megértése elengedhetetlen a kémia, a fizika, a biológia és a mérnöki tudományok számos területén.
Ebben a részletes elemzésben mélyrehatóan feltárjuk az Arrhenius-egyenlet minden aspektusát. Kezdjük az elméleti alapokkal, megvizsgáljuk a mögöttes fizikai és kémiai elveket. Ezt követően részletesen bemutatjuk az egyenlet matematikai formáját és az egyes paraméterek jelentését. Kitérünk az egyenlet levezetésére, a kísérleti meghatározás módszereire, valamint a gyakorlati alkalmazások széles körére. Végül megvizsgáljuk az Arrhenius-egyenlet korlátait és azokat a kiterjesztéseket, amelyek a komplexebb rendszerek leírására szolgálnak.
Célunk, hogy egy átfogó és érthető képet nyújtsunk az Arrhenius-egyenletről, amely nem csupán a diákok és a kutatók számára lehet hasznos, hanem mindenki számára, aki érdeklődik a kémiai reakciók világa iránt. Merüljünk el tehát a reakciósebesség hőmérsékletfüggésének lenyűgöző világában!
Az Arrhenius-egyenlet matematikai formája és paraméterei
Az Arrhenius-egyenlet matematikai formája a következő:
$\displaystyle k = A \cdot e^{ -\frac{E_a}{RT}}$
Ahol:
- $k$ a sebességi állandó, amely megmutatja, hogy egy adott hőmérsékleten milyen gyorsan megy végbe a reakció. Egysége a reakció rendjétől függ.
- $A$ a frekvenciafaktor (vagy pre-exponenciális faktor), amely a molekulák ütközésének gyakoriságát és a megfelelő orientációval történő ütközések arányát képviseli. Egysége megegyezik a sebességi állandó egységével.
- $E_a$ az aktiválási energia, amely az a minimális energia, amelyre a reaktáns molekuláknak szükségük van ahhoz, hogy a reakció végbemenjen. Egysége általában joule/mol (J/mol) vagy kilojoule/mol (kJ/mol).
- $R$ az univerzális gázállandó, amelynek értéke körülbelül 8.314 J/(mol·K).
- $T$ az abszolút hőmérséklet Kelvinben (K).
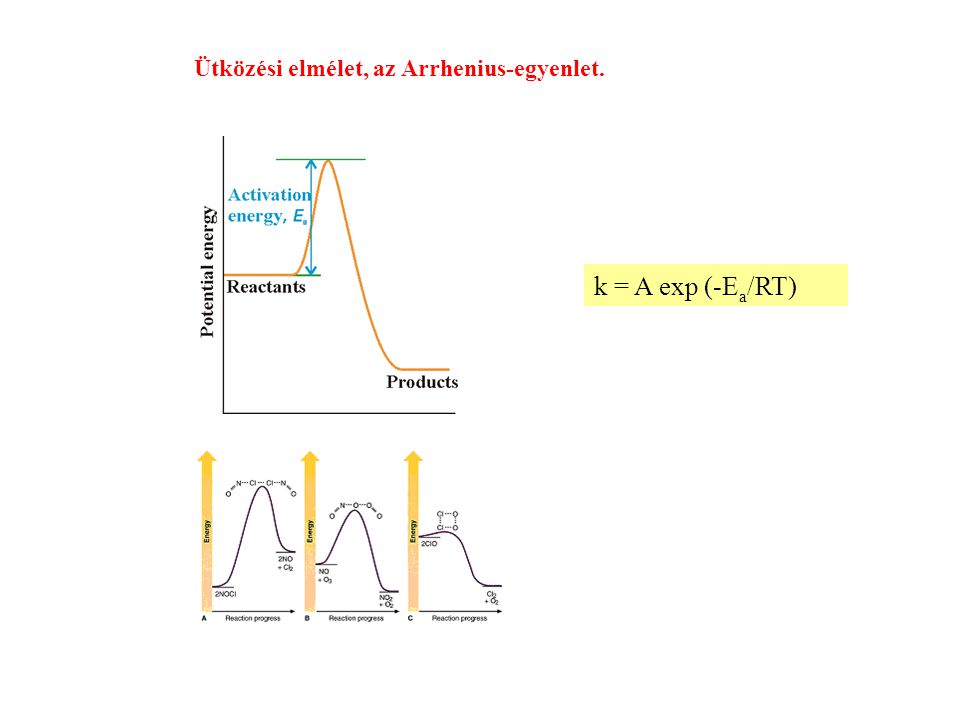
A sebességi állandó (k) jelentősége
A sebességi állandó ($k$) egy kulcsfontosságú mennyiség a kémiai kinetikában. Azt mutatja meg, hogy egy adott reakció milyen gyorsan megy végbe adott körülmények között. Nagyobb sebességi állandó gyorsabb reakciót jelent. Az Arrhenius-egyenlet éppen azt írja le, hogy ez a sebességi állandó hogyan változik a hőmérséklet függvényében.
A frekvenciafaktor (A) részletesebb bemutatása
A frekvenciafaktor ($A$), más néven pre-exponenciális faktor, két fő tényezőt foglal magában: az ütközések gyakoriságát a reaktáns molekulák között, és annak a valószínűségét, hogy egy ütközés megfelelő orientációval történik a reakció lejátszódásához. Az ütközési elmélet alapján az $A$ arányos az ütközések számával egységnyi idő alatt és egységnyi térfogatban. Azonban nem minden ütközés vezet reakcióhoz; a molekuláknak megfelelő orientációban kell ütközniük ahhoz, hogy a kötésátrendeződés megtörténhessen. A frekvenciafaktor ezt az orientációs tényezőt is magában foglalja.
Az aktiválási energia (Ea) mint a reakció gátja
Az aktiválási energia ($E_a$) az a minimális energiakülönbség a reaktánsok és az átmeneti állapot között. A reaktáns molekuláknak elegendő kinetikus energiával kell rendelkezniük ahhoz, hogy legyőzzék ezt az energiagátat és elérjék az átmeneti állapotot, amelyből aztán termékekké alakulhatnak. Magasabb aktiválási energia azt jelenti, hogy kevesebb molekulának van elegendő energiája az átlépéshez, így a reakció lassabb lesz. Az Arrhenius-egyenlet exponenciális tagja ($e^{ -\frac{E_a}{RT}}$) azt mutatja meg, hogy a reakció sebessége rendkívül érzékeny az aktiválási energia értékére.
Az univerzális gázállandó (R) szerepe
Az univerzális gázállandó ($R$) egy fizikai állandó, amely számos termodinamikai és kinetikai egyenletben megjelenik. Az Arrhenius-egyenletben az energia és a hőmérséklet közötti kapcsolatot skálázza. Értéke állandó, és a használt energiaegységektől függően változhat (pl. J/(mol·K) vagy cal/(mol·K)).

A hőmérséklet (T) hatása a reakciósebességre
Az Arrhenius-egyenlet egyik legfontosabb következménye, hogy a reakciósebesség exponenciálisan növekszik a hőmérséklet emelkedésével. Ennek oka az exponenciális tag ($e^{ -\frac{E_a}{RT}}$), amely azt mutatja, hogy ahogy a hőmérséklet nő, egyre több molekulának lesz elegendő energiája az aktiválási energia legyőzéséhez. Ez a jelenség magyarázza, hogy miért gyorsulnak fel a kémiai reakciók melegítés hatására.
Az Arrhenius-egyenlet levezetése
Az Arrhenius-egyenlet levezetéséhez termodinamikai és statisztikus mechanikai megfontolásokra van szükség. Bár a teljes levezetés meglehetősen komplex lehet, bemutatjuk a főbb lépéseket és az alapvető gondolatmenetet.
A sebességi állandó és az egyensúlyi állandó kapcsolata
Tekintsünk egy elemi, megfordítható reakciót:
$\displaystyle A + B \underset{k_{ -1}}{\stackrel{k_1}{\rightleftharpoons}} C$
Ahol $k_1$ az előreirányuló reakció sebességi állandója, $k_{ -1}$ pedig a visszafelé irányuló reakcióé. Az egyensúlyi állandó ($K$) kifejezhető a sebességi állandók hányadosaként:
$\displaystyle K = \frac{k_1}{k_{ -1}}$
A termodinamika szerint az egyensúlyi állandó hőmérsékletfüggését a van’t Hoff-egyenlet írja le:

$\displaystyle \frac{d \ln K}{dT} = \frac{\Delta H^\circ}{RT^2}$
Ahol $\Delta H^\circ$ a standard reakcióentalpia.

Az aktivált komplex elmélet
Az Arrhenius-egyenlet levezetésének egy másik megközelítése az aktivált komplex elmélet (vagy átmeneti állapot elmélet). Ez az elmélet feltételezi, hogy a reaktánsok először egy instabil, magas energiájú átmeneti állapotot (aktivált komplexet) képeznek, mielőtt termékekké alakulnának.
A reakció sématikusan így ábrázolható:
$\displaystyle A + B \rightleftharpoons [AB]^\ddagger \rightarrow C$
Ahol $[AB]^\ddagger$ az aktivált komplex. Az elmélet szerint a sebességi állandó arányos az aktivált komplex koncentrációjával és annak bomlási sebességével a termékek felé.
A levezetés főbb lépései
Bár a részletes matematikai levezetés itt nem fér bele, a lényeg az, hogy a sebességi állandó hőmérsékletfüggése az aktiválási energiával és a hőmérséklettel exponenciális kapcsolatban áll. A levezetés során figyelembe veszik a molekulák energiaeloszlását (Maxwell-Boltzmann eloszlás) és annak a valószínűségét, hogy egy ütköző pár elegendő energiával rendelkezik az aktiválási gát leküzdéséhez.
Az Arrhenius eredeti megközelítése nagyrészt empirikus volt, de később elméleti alapot is kapott a statisztikus mechanika és az aktivált komplex elmélet révén. A lényeg, hogy a reakció sebessége függ attól, hogy hány molekula rendelkezik az aktiválási energiánál nagyobb energiával, és ez a szám exponenciálisan nő a hőmérséklettel.
Az aktiválási energia (Ea) kísérleti meghatározása
Az aktiválási energia ($E_a$) és a frekvenciafaktor ($A$) kísérletileg meghatározható a sebességi állandó ($k$) különböző hőmérsékleteken történő mérésével.
A logaritmikus forma
Az Arrhenius-egyenlet logaritmikus formája a következő:
$\displaystyle \ln k = \ln A – \frac{E_a}{R} \cdot \frac{1}{T}$
Ez az egyenlet egy egyenes vonal egyenletének ($y = mx + b$) felel meg, ahol:
- $y = \ln k$
- $x = \frac{1}{T}$
- $m = -\frac{E_a}{R}$ (a vonal meredeksége)
- $b = \ln A$ (az y-tengelymetszet)
Grafikus módszer
A kísérleti adatok alapján, ha ábrázoljuk $\ln k$-t $1/T$ függvényében, egy egyenes vonalat kapunk. A vonal meredekségéből meghatározható az aktiválási energia:
$\displaystyle E_a = -R \cdot \text{meredekség}$
Az y-tengelymetszetből pedig a frekvenciafaktor számítható ki:
$\displaystyle A = e^{\text{y-tengelymetszet}}$
Kétpontos módszer

Ha a sebességi állandót két különböző hőmérsékleten ismerjük ($k_1$ bei $T_1$ és $k_2$ bei $T_2$), akkor az aktiválási energia közvetlenül is kiszámítható:
$\displaystyle \ln \left( \frac{k_2}{k_1} \right) = \frac{E_a}{R} \left( \frac{1}{T_1} – \frac{1}{T_2} \right)$
Ebből az egyenletből $E_a$ kifejezhető:
$\displaystyle E_a = R \cdot \frac{\ln(k_2/k_1)}{(1/T_1) – (1/T_2)}$
Miután $E_a$ ismert, a frekvenciafaktor ($A$) az eredeti Arrhenius-egyenletből vagy annak logaritmikus formájából számítható ki bármelyik mérési pont felhasználásával.
Az Arrhenius-egyenlet gyakorlati alkalmazásai
Az Arrhenius-egyenletnek rendkívül széles körű gyakorlati alkalmazásai vannak a különböző tudományterületeken és az iparban.
Kémiai reakciók sebességének előrejelzése
Az egyik legfontosabb alkalmazás a kémiai reakciók sebességének előrejelzése különböző hőmérsékleteken, ha az aktiválási energia és a frekvenciafaktor ismert. Ez elengedhetetlen a reaktorok tervezéséhez, a reakciókörülmények optimalizálásához és a termékhozam maximalizálásához.
Reakciómechanizmusok tanulmányozása
Az aktiválási energia értéke betekintést nyújthat a reakciómechanizmusba. Magas aktiválási energia összetett, több lépésből álló reakciót vagy olyan lépést jelezhet, amely jelentős átrendeződést igényel a molekulákban. Alacsony aktiválási energia egyszerűbb mechanizmusra utalhat.
Élettudományok
Az Arrhenius-egyenlet elvét alkalmazzák biológiai folyamatok hőmérsékletfügg