Elektrod Fogalma
Az Elektród Fogalma: Átfogó Értelmezés és Alkalmazások
Ebben a kimerítő cikkben részletesen feltárjuk az elektród fogalmát, annak alapvető működési elveit, a különböző típusait, azokat az anyagokat, amelyekből készülnek, valamint a legfontosabb alkalmazási területeit a tudomány, az ipar és a mindennapi élet számos területén. Célunk, hogy egy olyan átfogó képet nyújtsunk, amely mindenki számára érthetővé teszi az elektródok jelentőségét, legyen szó akár diákról, kutatóról vagy a téma iránt érdeklődő laikus olvasóról.
Mi Az Az Elektród? Az Alapvető Definíció
Az elektród egy elektromosan vezető anyagból készült alkatrész, amely egy elektromos áramkör és egy nem fémes rész (például elektrolit, vákuum vagy félvezető) között biztosítja az elektromos áram áramlását. Legegyszerűbb formájában egy fémlemez vagy huzal lehet, de komplexebb rendszerekben speciális anyagokból és szerkezetekből épül fel, optimalizálva az adott alkalmazás követelményeinek megfelelően.
Az Elektródok Kulcsfontosságú Szerepe az Elektrokémiai Folyamatokban
Az elektródok központi szerepet játszanak az elektrokémiai folyamatokban, ahol kémiai reakciók mennek végbe elektromos áram hatására vagy elektromos áram termelődik kémiai reakciók révén. Két fő típusa létezik az elektródoknak az elektrokémiai cellákban:
Az Anód: Az Oxidáció Helyszíne
Az anód az az elektród, amelyen az oxidációs folyamat zajlik. Oxidáció során egy anyag elektronokat veszít. Egy galvánelemben (amely spontán kémiai reakciók révén termel elektromos áramot, mint például egy elem) az anód a negatív pólus, ahonnan az elektronok a külső áramkörbe áramlanak. Elektrolízis során (ahol elektromos áramot vezetnek egy oldaton vagy olvadékon keresztül kémiai változások előidézésére) az anód a pozitív pólus, amelyhez az anionok (negatív ionok) vándorolnak, és ahol oxidálódnak.
Az Anód Működési Mechanizmusa Részletesen
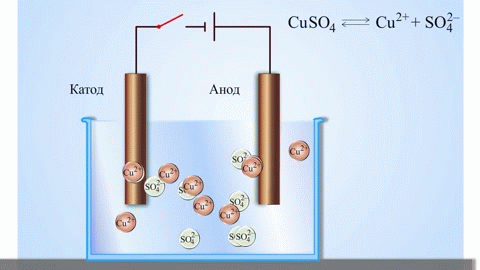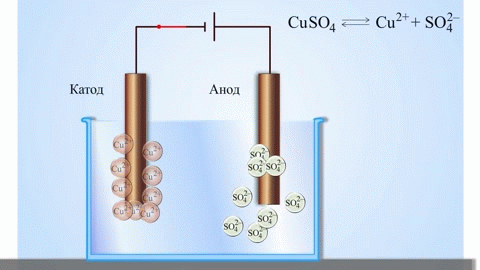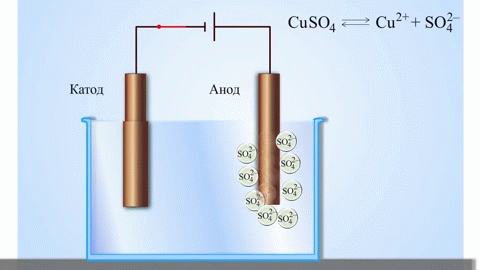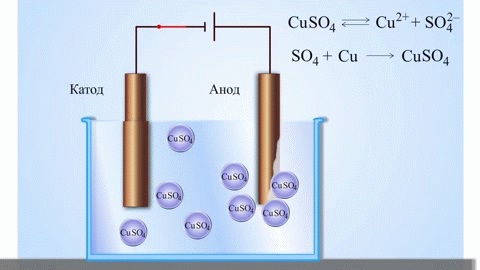
Egy galvánelemben az anódon lévő fém atomjai elektronokat adnak le, így pozitív ionokká alakulnak, amelyek az elektrolitba kerülnek. A felszabaduló elektronok a külső áramkörön keresztül a katódhoz áramlanak. Például egy cink-réz galvánelemben a cink elektród az anód:
$$\mathrm{Zn(s) \rightarrow Zn^{2+}(aq) + 2e^- }$$
Elektrolízis során az anódhoz érkező anionok (például kloridionok egy sóoldat elektrolízisekor) elektronokat adnak le, oxidálódnak. Például:
$$\mathrm{2Cl^-(aq) \rightarrow Cl_2(g) + 2e^- }$$
Az anód anyagának megválasztása kritikus fontosságú, függ az adott elektrokémiai rendszer követelményeitől, beleértve a reakciókinetikát és a korrózióállóságot.
A Katód: A Redukció Helyszíne

A katód az az elektród, amelyen a redukciós folyamat zajlik. Redukció során egy anyag elektronokat vesz fel. Egy galvánelemben a katód a pozitív pólus, ahová az elektronok a külső áramkörből érkeznek, és ahol a redukció bekövetkezik. Elektrolízis során a katód a negatív pólus, amelyhez a kationok (pozitív ionok) vándorolnak, és ahol redukálódnak.
A Katód Működési Mechanizmusa Részletesen
Egy galvánelemben a katódnál lévő ionok (vagy molekulák) a külső áramkörből érkező elektronokat felveszik, és redukálódnak. A cink-réz galvánelemben a réz elektród a katód, ahol a réz(II)-ionok redukálódnak:
$$\mathrm{Cu^{2+}(aq) + 2e^- \rightarrow Cu(s)}$$

Elektrolízis során a katódhoz érkező kationok (például nátriumionok olvadt só elektrolízisekor) elektronokat vesznek fel, redukálódnak. Például:
$$\mathrm{Na^+(l) + e^- \rightarrow Na(l)}$$
A katód anyagának kiválasztása szintén kulcsfontosságú, befolyásolja a reakció sebességét és a mellékreakciók elkerülését.
Az Elektródok Anyagai: A Sokféleség és a Funkcionalitás
Az elektródok készülhetnek számos különböző anyagból, attól függően, hogy milyen alkalmazásra szánják őket. A leggyakrabban használt anyagok közé tartoznak a fémek, a szén különböző allotrópjai (például grafit, szénszál), valamint bizonyos félvezető anyagok és polimerek.
Fém Elektródok: A Klasszikus Választás
A fém elektródok széles körben elterjedtek kiváló elektromos vezetőképességük és viszonylag egyszerű előállításuk miatt. Különböző fémeket használnak elektródként, mint például a réz, a cink, az ezüst, a platina és az arany. A fém megválasztása függ az elektrokémiai rendszerben zajló reakcióktól és a kívánt stabilitástól.
Nemesfémek az Elektródokban
A nemesfémek, mint a platina és az arany, különösen kedveltek olyan alkalmazásokban, ahol magas kémiai inertségre van szükség, mivel ellenállnak a korróziónak és nem vesznek részt nem kívánt reakciókban. Gyakran használják őket referencia elektródokként és katalizátorként elektrokémiai folyamatokban.
Aktív Fémek az Elektródokban
Az aktív fémek, mint a cink és a lítium, elengedhetetlenek az akkumulátorokban, ahol nagy energiasűrűségre van szükség. Ezek a fémek könnyen oxidálódnak, így nagy mennyiségű elektron leadására képesek.
Szén Alapú Elektródok: Sokoldalúság és Megfizethetőség
A szén alapú elektródok, különösen a grafit és a szénszál, szintén elterjedtek elektrokémiai alkalmazásokban. Jó elektromos vezetőképességgel rendelkeznek, kémiailag viszonylag inertnek mondhatók, és költségük kedvezőbb a nemesfémekhez képest. Használják őket akkumulátorokban, üzemanyagcellákban és szenzorokban.
Grafit Elektródok
A grafit elektródok mechanikailag stabilak és jól megmunkálhatók. Réteges szerkezetük lehetővé teszi ionok interkalációját (beékelődését), ami fontos az akkumulátorok működésében.
Szénszál Elektródok
A szénszál elektródok nagy felületük miatt előnyösek olyan alkalmazásokban, ahol nagy reakciósebességre van szükség, például bioszenzorokban.
Félvezető Elektródok: A Fény és Az Elektrokémia Találkozása
A félvezető elektródok, mint például a titán-dioxid ($\mathrm{TiO_2}$) és a szilícium ($\mathrm{Si}$), különleges tulajdonságokkal rendelkeznek, amelyek lehetővé teszik a fényelektrokémiai alkalmazásokat, például a napelemeket és a fotokatalízist. Fény hatására elektron-lyuk párok keletkeznek a félvezetőben, amelyek részt vehetnek redox reakciókban az elektród felületén.
Polimer Elektródok: A Rugalmasság és a Biokompatibilitás
A polimer elektródok újabb fejlesztések eredményei, amelyek rugalmasságot és biokompatibilitást kínálnak. Vezetőképes polimereket használnak például bioelektronikai eszközökben és rugalmas akkumulátorokban.
Az Elektródok Típusai Alkalmazás Szerint
Az elektródokat különböző szempontok szerint csoportosíthatjuk. Az elektrokémiai cellákban betöltött szerepük (anód vagy katód) mellett megkülönböztethetünk speciális típusokat is az alkalmazási területük alapján.
Referencia Elektródok: A Potenciál Mérésének Alapja
A referencia elektródok olyan elektródok, amelyek potenciálja ismert és stabil. Ezeket használják más elektródok potenciáljának mérésére elektrokémiai kísérletekben. Néhány gyakori referencia elektród a standard hidrogén elektród (SHE), a kalomel elektród és az ezüst/ezüst-klorid elektród.
A Standard Hidrogén Elektród (SHE)
A standard hidrogén elektród (SHE) a többi elektródpotenciál mérésének alapja. Definíció szerint a potenciálja 0 V standard körülmények között (298 K, 1 atm hidrogéngáz, 1 M $\mathrm{H^+}$ ion koncentráció). Egy platina elektródból áll, amelyet hidrogéngázzal buborékoltatnak át egy savas oldatban.
A Kalomel Elektród
A kalomel elektród egy gyakran használt referencia elektród, amely higanyból, higany(I)-kloridból (kalomel) és egy kloridionokat tartalmazó oldatból áll. Potenciálja a kloridion koncentrációjától függ.
Az Ezüst/Ezüst-Klorid Elektród
Az ezüst/ezüst-klorid elektród egy másik elterjedt referencia elektród, amely egy ezüstdrótból áll, amelyet ezüst-klorid réteg borít, és egy kloridionokat tartalmazó oldatba merítik. Stabil és könnyen használható.
Munkalelektródok: Ahol A Reakció Történik
A munkalelektródok azok az elektródok, ahol a vizsgált elektrokémiai reakció ténylegesen végbemegy. Ezek lehetnek különböző anyagokból és formákból, a kísérlet vagy az alkalmazás követelményeitől függően.

Segédelektródok: Az Áramkör Bezárása
Egy háromelektródos elektrokémiai cellában a segédelektród (vagy ellen-elektród) arra szolgál, hogy az áramkört bezárja a munkalelektróddal, anélkül, hogy a segédelektród potenciálját kontrollálnák vagy mérnék.
Az Elektródok Alkalmazási Területei: A Mindennapi Élettől a Csúcstechnológiáig
Az elektródok nélkülözhetetlenek számos technológiai területen. Az alábbiakban néhány fontosabb alkalmazási területet tekintünk át.
Akkumulátorok és Elemek: Az Energiatárolás Alapjai
Az akkumulátorok és az elemek elektrokémiai cellák, amelyek elektródokat használnak az elektromos energia kémiai energiává történő átalakítására (töltéskor) és vissza (kisütéskor). A legelterjedtebb akkumulátortípusokban (például lítium-ion, nikkel-metál-hidrid) különböző anyagokból készült anódok és katódok találhatók, amelyek között elektrolit biztosítja az ionok áramlását.
Lítium-ion Akkumulátorok Elektródjai
A lítium-ion akkumulátorokban tipikusan grafitot használnak az anódhoz, és fém-oxidokat (például lítium-kobalt-oxid, lítium-vas-foszfát) a katódhoz. A lítium-ionok mozgása az elektródok között teszi lehetővé a töltést és a kisütést.
Elektrolízis: Kémiai Anyagok Előállítása Elektromos Árammal
Az elektrolízis egy olyan folyamat, amelynek során elektromos áramot vezetnek egy elektroliton keresztül, hogy nem spontán kémiai reakciókat idézzenek elő. Az elektródok (anód és katód) itt kulcsszerepet játszanak a reakciók felületének biztosításában. Például a víz elektrolízisével hidrogént és oxigént állítanak elő, a sóolvadékok elektrolízisével pedig tiszta fémeket, mint az alumínium.
Galvánelemek (Voltaikus Cellák): Elektromos Áram Kémiai Reakciókból
A galvánelemek (vagy voltaikus cellák) olyan eszközök, amelyek spontán redox reakciók energiáját elektromos energiává alakítják. Két különböző fémből készült elektródot tartalmaznak, amelyek elektroliton keresztül vannak összekötve. A legismertebb példa a Daniell-elem (cink-réz elem).
Szenzorok: Kémiai és Biológiai Anyagok Érzékelése
Az elektrokémiai szenzorok elektródokat használnak a különböző kémiai és biológiai anyagok koncentrációjának vagy jelenlétének mérésére. A mérendő anyag reakcióba lép az elektród felületén, ami elektromos jel változását eredményezi, amelyet aztán detektálni lehet. Ilyen szenzorokat használnak például a vércukorszint mérésére (glükóz-elektród) vagy a környezeti monitoringban.
Bioszenzorok

A bioszenzorok speciális elektrokémiai szenzorok, amelyek biológiai elemeket (például enzimeket, antitesteket) tartalmaznak a célanyag nagy