Endoterm Folyamat

Az Endoterm Folyamatok Mélyreható Tanulmányozása
Ebben az átfogó cikkben részletesen feltárjuk az endoterm folyamatok lenyűgöző világát. Megvizsgáljuk, hogy mi is pontosan egy hőelnyelő reakció, milyen alapelvek vezérlik, és hogyan jelenik meg a mindennapi életünkben és a tudományos kutatásokban egyaránt. Célunk, hogy egy olyan mélyreható tudást nyújtsunk, amely nemcsak a fogalmak megértéséhez segít hozzá, hanem képessé tesz az endoterm folyamatok azonosítására és elemzésére is.
Mi az az Endoterm Folyamat? A Hőelnyelés Mechanizmusa
Az endoterm folyamat lényegében egy olyan fizikai vagy kémiai változás, amelynek során a rendszer hőt vesz fel a környezetéből. Ez azt jelenti, hogy a reakció vagy a folyamat lejátszódásához energia befektetésére van szükség hő formájában. Ennek következtében a rendszer belső energiája növekszik, míg a környezet hőmérséklete csökkenhet, ha nem történik kompenzáló hőcsere. A hőelnyelés a folyamat hajtóereje, és ez különbözteti meg az endoterm folyamatokat az exoterm folyamatoktól, amelyek hőt adnak le a környezetüknek.
A Termodinamika Első Főtételének Szerepe
A termodinamika első főtétele, az energia megmaradásának elve, kulcsfontosságú az endoterm folyamatok megértéséhez. Ez a törvény kimondja, hogy egy zárt rendszer energiája állandó marad, bár formája megváltozhat. Egy endoterm folyamat során a rendszer energiája úgy növekszik, hogy hőt vesz fel a környezetből. Ezt a következő egyenlettel fejezhetjük ki:
$$\Delta U = Q – W$$
ahol $\Delta U$ a belső energia változása, $Q$ a rendszerrel közölt hő, és $W$ a rendszer által végzett munka. Egy endoterm folyamat esetében $Q > 0$, ami hozzájárul $\Delta U$ növekedéséhez, feltéve, hogy a végzett munka nem kompenzálja ezt a hőfelvételt teljes mértékben.
Az Entalpia Változásának Jelentősége
Kémiai reakciók vizsgálatakor gyakran az entalpia ($H$) változását használjuk a hőcsere leírására állandó nyomáson. Az entalpia definíció szerint $H = U + PV$, ahol $P$ a nyomás és $V$ a térfogat. Állandó nyomáson a hőcsere ($\Delta H$) egyenlő a rendszerrel közölt hővel ($Q_p$). Egy endoterm reakció esetében az entalpia változása pozitív ($\Delta H > 0$), ami azt jelzi, hogy a rendszer energiatartalma nőtt a hőfelvétel következtében.
Endoterm Folyamatok Példái a Mindennapi Életben
Számos olyan jelenséggel találkozhatunk a mindennapi életünkben, amelyek endoterm folyamatok eredményei. Ezeknek a példáknak a megértése segít abban, hogy jobban átlássuk a hőelnyelés szerepét a különböző fizikai és kémiai változásokban.
A Jég Olvadása: Fázisátalakulás Hőfelvétellel

A jég olvadása egy klasszikus példa az endoterm folyamatra. Amikor a jég hőt vesz fel a környezetéből, a jégkristályokat összetartó kötések gyengülnek, és a jég folyékony vízzé alakul. Ehhez a fázisátalakuláshoz energia szükséges, amelyet a környezet hője biztosít. Ha egy pohár vizet jégkockákkal hűtünk, a jég olvadása közben hőt von el a víztől, így a víz hőmérséklete csökken.
A Víz Párolgása: Energia Szükséges a Folyadékból Gázba Átalakuláshoz
A víz párolgása egy másik gyakori endoterm folyamat. Ahhoz, hogy a vízmolekulák a folyékony fázisból a gázfázisba kerüljenek, le kell győzniük a közöttük lévő vonzóerőket. Ez energiát igényel, amelyet a víz a környezetéből vesz fel hő formájában. Ezért érezzük hűvösnek a bőrünket, amikor a rajta lévő víz elpárolog, hiszen a párolgáshoz szükséges hőt a bőrünktől vonja el.
A Fotoszintézis: Növények Hőelnyelő Folyamata az Élethez
A fotoszintézis egy biokémiai endoterm folyamat, amelynek során a növények a napfény energiáját felhasználva szén-dioxidból és vízből glükózt és oxigént állítanak elő. A napfény energiája itt a szükséges hőenergiát helyettesíti, amely lehetővé teszi a nem spontán kémiai reakciók lejátszódását. Ez a folyamat elengedhetetlen az élet fenntartásához a Földön.
A Kalcium-karbonát Bomlása: Hő hatására bekövetkező kémiai változás
A kalcium-karbonát ($CaCO_3$) hő hatására történő bomlása kalcium-oxidra ($CaO$) és szén-dioxidra ($CO_2$) egy endoterm kémiai reakció. Ahhoz, hogy ez a reakció végbemenjen, magas hőmérsékletre van szükség, amely biztosítja a szükséges energiát a kémiai kötések felbontásához. Ezt a reakciót az építőiparban is alkalmazzák a mészgyártás során.
A Nitrátok Oldódása Vízben: Hőmérséklet-csökkenéssel járó folyamat
Bizonyos sók, például az ammónium-nitrát ($NH_4NO_3$) oldódása vízben egy endoterm folyamat. Amikor az ammónium-nitrátot vízben feloldjuk, a rendszer hőt von el a környezetéből, ami a víz hőmérsékletének csökkenéséhez vezet. Ezt a jelenséget hűtőtasakokban is kihasználják.
Endoterm Folyamatok a Tudományban és az Ipari Alkalmazásokban
Az endoterm folyamatok nemcsak a mindennapi életünkben játszanak fontos szerepet, hanem a tudományos kutatások és az ipari alkalmazások területén is nélkülözhetetlenek.
Kémiai Laboratóriumok: Endoterm Reakciók Szintézise

A kémiai laboratóriumokban számos olyan szintézis létezik, amely endoterm reakciókon alapul. Ezek a reakciók gyakran kontrollált körülmények között, hő hozzáadásával mennek végbe, hogy a kívánt termékeket előállítsák. A reakcióhő ismerete elengedhetetlen a kísérletek tervezéséhez és a biztonságos munkavégzéshez.
Ipari Folyamatok: Hőelnyelés a Termelésben
Az iparban is számos endoterm folyamatot alkalmaznak. Például a fémek olvasztása magas hőmérsékleten történik, ami egy hőelnyelő folyamat. Hasonlóképpen, bizonyos vegyipari eljárások is hő befektetését igénylik a kívánt termékek előállításához.
Hűtési Technológiák: Az Endoterm Folyamatok Hűtőhatása
A hűtési technológiák gyakran használnak ki endoterm folyamatokat. A hűtőszekrények és légkondicionálók működése olyan anyagok fázisváltozásán alapul, amelyek hőt vonnak el a környezetükből párolgásuk során. Az ammónia és a freon korábban elterjedt hűtőközegek voltak, amelyek endoterm párolgásukkal hűtöttek.
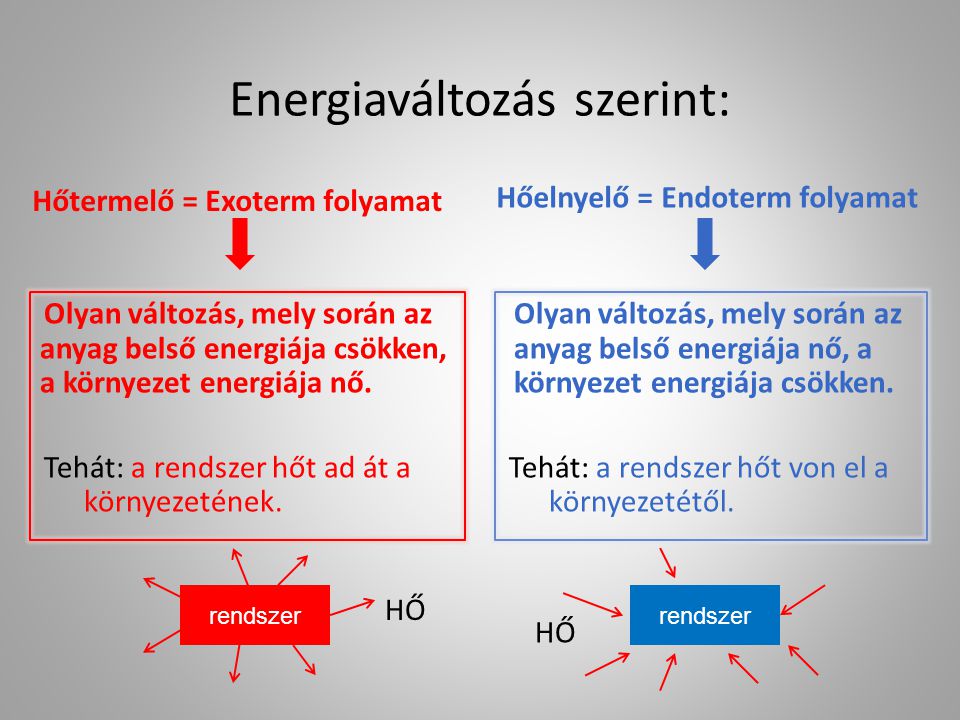
Az Endoterm és Exoterm Folyamatok Összehasonlítása
Az endoterm folyamatok ellentétei az exoterm folyamatok, amelyek hőt adnak le a környezetüknek. A két típusú folyamat közötti különbség a hőcsere irányában rejlik. Míg az endoterm folyamatok energiát (hőt) nyelnek el, az exoterm folyamatok energiát (hőt) szabadítanak fel.
Energiaváltozás: A Különbség Lényege
Egy endoterm folyamat során a rendszer belső energiája nő, mivel hőt vesz fel. Ezzel szemben egy exoterm folyamat során a rendszer belső energiája csökken, mivel hőt ad le. Az entalpia változása ($\Delta H$) pozitív az endoterm, és negatív az exoterm folyamatok esetében.
Példák az Exoterm Folyamatokra
Exoterm folyamatokra példa az égés (pl. fa égése), a legtöbb sav-bázis reakció, és a víz fagyása jéggé. Ezekben az esetekben a rendszer hőt ad le a környezetének, amit gyakran hőmérséklet-emelkedésként érzékelünk.
Hogyan Azonosíthatunk Egy Endoterm Folyamatot?
Számos jel utalhat arra, hogy egy folyamat endoterm. Ezeknek a jeleknek a megfigyelése segíthet a folyamat természetének megértésében.
Hőmérséklet Változása a Környezetben
Az egyik legnyilvánvalóbb jele egy endoterm folyamatnak, ha a környezet hőmérséklete csökken. Például, amikor egy sót feloldunk vízben és a víz lehűl, az oldódási folyamat valószínűleg endoterm.
Hő Befektetésének Szükségessége
Ha egy folyamat csak akkor megy végbe, ha folyamatosan hőt adunk hozzá, az szintén arra utal, hogy a folyamat endoterm. A víz forralása például folyamatos hőbevitelt igényel a párolgáshoz.
Pozitív Entalpia Változás ($\Delta H > 0$)
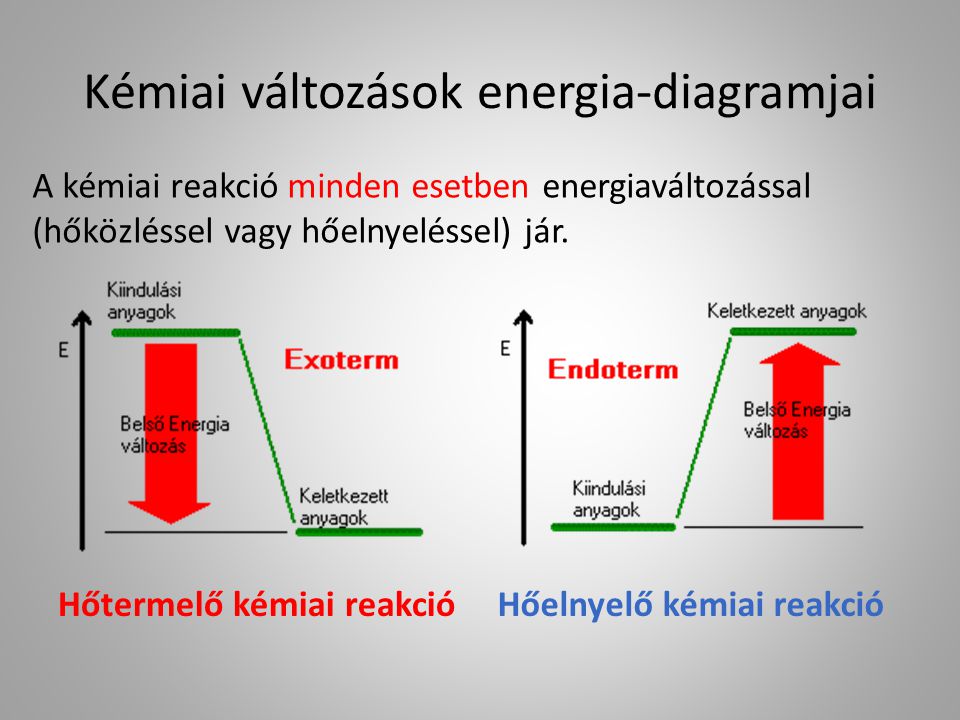
Kémiai reakciók esetében a reakcióhő (entalpia változás) előjele egyértelműen jelzi, hogy a reakció endoterm vagy exoterm. Ha $\Delta H > 0$, a reakció endoterm.
Az Endoterm Folyamatok Energetikai Szempontjai
Az endoterm folyamatok energetikai szempontból olyan változások, amelyek energia befektetését igénylik. Ez az energia általában hő formájában kerül a rendszerbe, de lehet más energiaforma is, például fény (mint a fotoszintézis esetében).
Aktiválási Energia és az Endoterm Reakciók
A kémiai reakciók megindulásához gyakran aktiválási energiára van szükség, mind az endoterm, mind az exoterm reakciók esetében. Az aktiválási energia az a minimális energia, amely szükséges a reaktánsok közötti ütközésekhez ahhoz, hogy a reakció végbemenjen. Egy endoterm reakció energia-diagramján a termékek energiaszintje magasabb, mint a reaktánsoké, és az energia különbség az entalpia változása ($\Delta H$).
A Hő Kapacitás Szerepe
A hő kapacitás egy anyag azon képességét jelzi, hogy mennyi hőt képes elnyelni anélkül, hogy a hőmérséklete jelentősen megváltozna. Az endoterm folyamatok során a rendszer hőmérsékletének változása függ a rendszer hő kapacitásától és a felvett hő mennyiségétől.
Összefoglalás: Az Endoterm Folyamatok Fontossága
Az endoterm folyamatok alapvető szerepet játszanak a természetben és a technológiában. A jég olvadásától a fotoszintézisig, a hűtési eljárásoktól a kémiai szintézisekig számos területen találkozhatunk velük. A hőelnyelés mechanizmusának megértése elengedhetetlen a termodinamikai elvek alkalmazásához és a különböző fizikai és kémiai jelenségek értelmezéséhez.
Reméljük, hogy ez a részletes útmutató segített elmélyíteni a tudásodat az endoterm folyamatokról. Ha további kérdéseid vannak, ne habozz feltenni őket!
További Részletek az Endoterm Folyamatok Mélyebb Megértéséhez
Ahhoz, hogy még átfogóbb képet kapjunk az endoterm folyamatokról, érdemes megvizsgálni néhány további aspektust, beleértve a mikroszkopikus szintű magyarázatokat és a kvantitatív jellemzőket.
Mikroszkopikus Szintű Magyarázat
Mikroszkopikus szinten az endoterm folyamatok során a rendszerben lévő atomok és molekulák mozgási energiája növekszik a felvett hő hatására. Például a jég olvadásakor a vízmolekulák rezgései erősebbé válnak, ami végül a kristályrács felbomlásához vezet. A párolgás során a folyadékban lévő molekulák elegendő kinetikus energiát nyernek ahhoz, hogy legyőzzék a szomszédos molekulák vonzóerőit és a gázfázisba lépjenek.
Kvantitatív Jellemzők: A Hőmennyiség Számítása
Az endoterm folyamatok során felvett hő mennyiségét kvantitatívan is meghatározhatjuk. Fázisátalakulások esetén a felvett hő ($q$) a következőképpen számítható:

$$q = m \cdot L$$
ahol $m$ az anyag tömege, és $L$ a fajlagos olvadáshő (olvadáskor) vagy a fajlagos párolgáshő (párolgáskor). Kémiai reakciók esetében a felvett hő a reakció entalpia változásával ($\Delta H$) egyenlő, ha a reakció állandó nyomáson megy végbe.
Az Entrópia Szerepe az Endoterm Folyamatokban
Bár az endoterm folyamatok energia befektetését igénylik, gyakran spontán módon is lejátszódhatnak, ha az entrópia (a rendszer rendezetlenségének mértéke) növekedése kellően nagy ahhoz, hogy kompenzálja az entalpia növekedését. A Gibbs-féle szabadenergia ($\Delta G = \Delta H – T\Delta S$) határozza meg a folyamat spontaneitását. Egy folyamat akkor spontán állandó hőmérsék