Endoterm Halmazallapot Valtozasok
Az Endoterm Halmazállapot-változások Részletes Tanulmánya
Ebben a kimerítő cikkben részletesen feltárjuk az endoterm halmazállapot-változások lényegét, bemutatva a mögöttük rejlő fizikai és kémiai mechanizmusokat. Célunk, hogy olvasóink átfogó képet kapjanak erről a fontos természeti jelenségről, amely számos mindennapi és ipari folyamat alapját képezi. Megvizsgáljuk az egyes endoterm átalakulásokat, azok jellemzőit, energiaigényét és a környezetükre gyakorolt hatásait. Kísérjük végig a molekulák szintjén zajló változásokat, és értsük meg, miért van szükség energia befektetésére ahhoz, hogy egy anyag egyik halmazállapotból a másikba lépjen.
Mi az az Endoterm Folyamat?
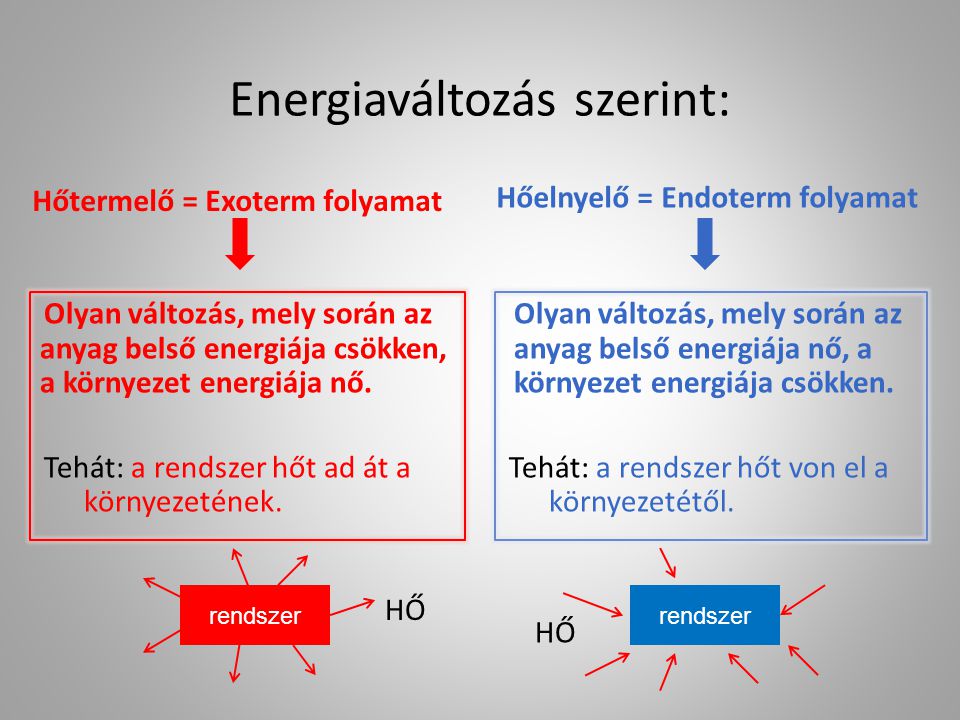
Mielőtt belemerülnénk a halmazállapot-változásokba, fontos tisztáznunk az endoterm folyamat fogalmát. Egy endoterm folyamat olyan rendszerben zajlik le, amely energiát – leggyakrabban hő formájában – vesz fel a környezetéből. Ennek eredményeként a rendszer belső energiája nő, míg a környezet hőmérséklete csökkenhet. Az endoterm folyamatokra jellemző, hogy az entalpiaváltozás ($\Delta H$) pozitív értékű. Számos fizikai és kémiai folyamat tartozik ide, beleértve bizonyos oldódásokat, kémiai reakciókat és természetesen a halmazállapot-változásokat, amelyekről ebben a cikkben részletesen szólunk.
Az Endoterm Halmazállapot-változások Meghatározása
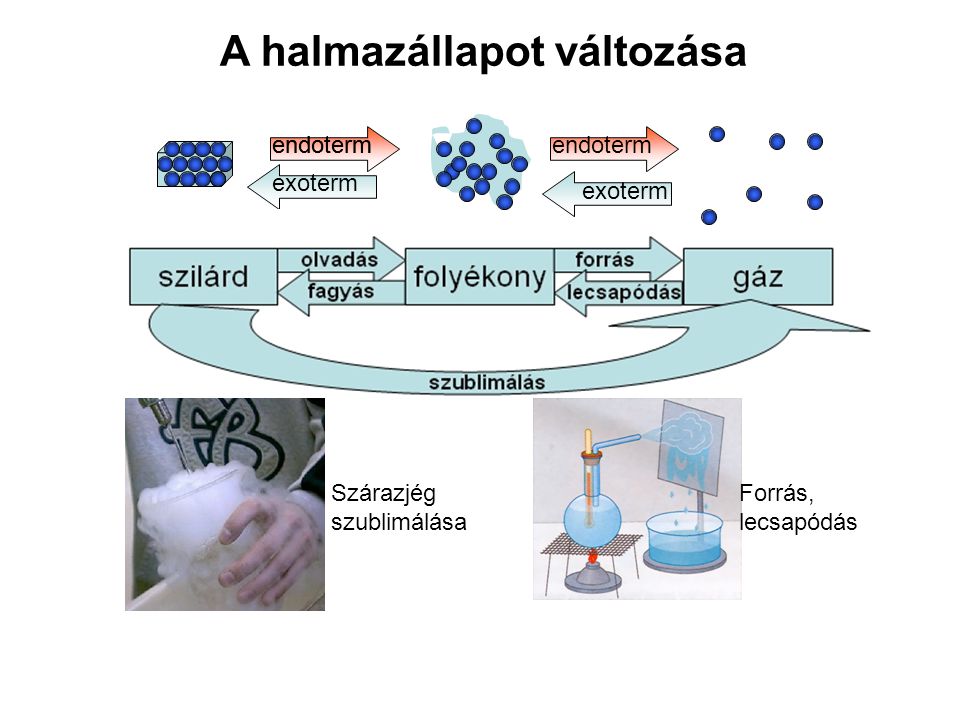
Az endoterm halmazállapot-változások olyan átalakulások, amelyek során egy anyag alacsonyabb energiaszintű halmazállapotból magasabb energiaszintű halmazállapotba kerül úgy, hogy ehhez hőt vesz fel a környezetéből. Ez azt jelenti, hogy az anyag részecskéinek mozgási energiája növekszik, ami lehetővé teszi a szorosabb kötőerők leküzdését. A leggyakoribb endoterm halmazállapot-változások az olvadás, a párolgás és a szublimáció. Mindhárom esetben energia befektetésére van szükség ahhoz, hogy a folyamat végbemenjen.
Az Olvadás: Szilárdból Folyékonyba
Az olvadás az a folyamat, amely során egy szilárd anyag folyékony halmazállapotba megy át hő hatására. Szilárd állapotban az atomok, ionok vagy molekulák rácsstruktúrában helyezkednek el, és viszonylag kis mozgási energiával rendelkeznek. Ahogy hőt adunk a szilárd anyaghoz, a részecskék rezgései egyre hevesebbé válnak. Amikor a bevitt energia eléri azt a szintet, amely elegendő a rácskötések legyőzéséhez, a szilárd szerkezet felbomlik, és az anyag folyékonnyá válik. Ezt a hőmérsékletet, amelyen az olvadás bekövetkezik, olvadáspontnak nevezzük. Az olvadáspont minden tiszta anyagra jellemző érték. Az olvadás endoterm folyamat, mivel energia szükséges a kötőerők legyőzéséhez és a rendezettebb szilárd állapotból a kevésbé rendezett folyékony állapotba való átmenethez.
Az Olvadáshő
Az olvadáshoz szükséges hő mennyiségét olvadáshőnek (vagy fúziós hőnek) nevezzük. Ez az a hőmennyiség, amely egységnyi tömegű szilárd anyag megolvasztásához szükséges az olvadáspontján anélkül, hogy a hőmérséklete megváltozna. Az olvadáshő anyagra jellemző fizikai állandó, amelyet általában J/kg vagy J/mol egységekben adnak meg. Például a jég olvadáshője körülbelül $334 \times 10^3 \, \text{J/kg}$. Ez azt jelenti, hogy 1 kg jég 0 °C-on történő megolvasztásához $334 \, \text{kJ}$ hő szükséges.
Példák az Olvadásra
- A jég megolvadása szobahőmérsékleten vagy napfény hatására.
- A vaj megolvadása serpenyőben.
- A fémek megolvasztása kohászati folyamatok során.
A Párolgás: Folyékonyból Gázba

A párolgás az a folyamat, amely során egy folyékony anyag gáz vagy gőz halmazállapotba megy át. A folyadékban a molekulák folyamatos mozgásban vannak, és különböző kinetikus energiával rendelkeznek. Néhány, a folyadék felszínén lévő, nagy energiájú molekula képes legyőzni a folyadékban lévő többi molekula által gyakorolt vonzóerőket, és a gáztérbe távozni. Ez a folyamat bármilyen hőmérsékleten végbemehet, de a párolgás sebessége a hőmérséklet növekedésével jelentősen nő. Amikor a párolgás a folyadék forráspontján következik be, akkor forrásnak nevezzük. A forráspont az a hőmérséklet, amelyen a folyadék gőznyomása eléri a külső nyomást. A párolgás is endoterm folyamat, mivel energia szükséges a molekulák közötti kohéziós erők legyőzéséhez és a rendezetlenebb gázállapot kialakításához.
A Párolgáshő
A párolgáshoz szükséges hő mennyiségét párolgáshőnek nevezzük. Ez az a hőmennyiség, amely egységnyi tömegű folyadék elpárologtatásához szükséges a forráspontján anélkül, hogy a hőmérséklete megváltozna. A párolgáshő szintén anyagra jellemző fizikai állandó, amelyet általában J/kg vagy J/mol egységekben adnak meg. Például a víz párolgáshője a forráspontján (100 °C) körülbelül $2260 \times 10^3 \, \text{J/kg}$. Ez azt jelenti, hogy 1 kg víz elpárologtatásához $2260 \, \text{kJ}$ hő szükséges.
A Párolgás és a Hűtés
Érdemes megjegyezni, hogy a párolgás hűtő hatással jár. Amikor a nagy energiájú molekulák elhagyják a folyadékot, a visszamaradó molekulák átlagos kinetikus energiája csökken, ami a folyadék hőmérsékletének csökkenéséhez vezet. Ezt a jelenséget használják ki például az izzadásnál, amikor a bőrön lévő verejték elpárologva hűti a testet.
Példák a Párolgásra
- A víz elpárolgása egy tó felszínéről.
- A verejték elpárolgása a bőrről.
- A folyékony nitrogén forrása szobahőmérsékleten.
A Szublimáció: Szilárdból Közvetlenül Gázba
A szublimáció az a folyamat, amely során egy szilárd anyag közvetlenül gáz vagy gőz halmazállapotba megy át anélkül, hogy közben folyékony fázisba kerülne. Ez a jelenség bizonyos anyagoknál fordul elő olyan körülmények között (hőmérséklet és nyomás), ahol a folyékony fázis nem stabil. A szublimáció is endoterm folyamat, mivel energia szükséges a szilárd rács szerkezetének felbontásához és a gázfázis kialakításához.
A Szublimációs Hő
A szublimációhoz szükséges hő mennyiségét szublimációs hőnek nevezzük. Ez az a hőmennyiség, amely egységnyi tömegű szilárd anyag közvetlen gázzá alakításához szükséges adott hőmérsékleten és nyomáson anélkül, hogy folyékony fázisba kerülne. A szublimációs hő megegyezik az olvadáshő és a párolgáshő összegével ugyanazon a hőmérsékleten (ha a folyékony fázis létezik). $\Delta H_{\text{szublimáció}} = \Delta H_{\text{olvadás}} + \Delta H_{\text{párolgás}}$.

Példák a Szublimációra

- A szárazjég (szilárd szén-dioxid) szublimációja szobahőmérsékleten.
- A jódkristályok hevítésekor lila gőz képződése.
- A naftalin (molyirtó) lassú eltűnése szobahőmérsékleten.
- A hó és a jég közvetlen párolgása fagyos, napos időben.
Az Endoterm Halmazállapot-változások Energetikai Szempontjai
Mindhárom említett endoterm halmazállapot-változás – az olvadás, a párolgás és a szublimáció – energiafelvétellel jár. Ez az energia a rendszer belső energiáját növeli, lehetővé téve a részecskék közötti kötőerők legyőzését és a rendezetlenebb, magasabb energiaszintű halmazállapot kialakulását. A hőmérséklet addig nem emelkedik, amíg az összes anyag át nem alakult az új halmazállapotba. A bevitt hőenergia a potenciális energia növelésére fordítódik, nem pedig a kinetikus energia növelésére, ami a hőmérséklet emelkedéséért felelős.
Hőmérséklet-idő Grafikonok Halmazállapot-változások Közben

Ha egy szilárd anyagot folyamatosan hevítünk, a hőmérséklete emelkedik mindaddig, amíg el nem éri az olvadáspontját. Ezen a ponton a hőmérséklet nem változik, amíg az összes szilárd anyag meg nem olvad. A bevitt hőenergia ekkor az olvadásra fordítódik. Amint az összes anyag folyékony halmazállapotba kerül, a további hőbevitel a hőmérséklet emelkedését eredményezi egészen a forráspontig. A forrásponton hasonló jelenség figyelhető meg: a hőmérséklet addig állandó marad, amíg az összes folyadék el nem párolog. Ezután a gáz hőmérséklete kezd emelkedni. Ezek a lépcsőzetes hőmérséklet-idő grafikonok jól szemléltetik, hogy a halmazállapot-változások izoterm folyamatok (állandó hőmérsékleten zajlanak), amíg az átalakulás teljesen be nem fejeződik.
Endoterm Halmazállapot-változások a Mindennapi Életben és az Ipari Alkalmazásokban
Az endoterm halmazállapot-változások számos területen játszanak fontos szerepet.
Hűtés és Klímaberendezések
A párolgás hűtő hatását széles körben alkalmazzák hűtőgépekben és klímaberendezésekben. A hűtőközeg (egy könnyen párolgó folyadék) elpárolgása hőt von el a hűtőtérből, ezáltal csökkentve annak hőmérsékletét. A keletkező gőzt ezután komprimálják, ami felmelegíti azt, majd egy hőcserélőn keresztül leadja a hőt a környezetnek, mielőtt újra cseppfolyósítanák és a ciklus kezdődne elölről.
Élelmiszeripar
Az olvadás és a fagyasztás (az olvadás fordítottja, amely exoterm folyamat) kulcsfontosságúak az élelmiszeriparban. A fagyasztás lehetővé teszi az élelmiszerek tartósítását, míg az olvasztás a felhasználás előtti állapot visszaállítását szolgálja. A liofilizálás (fagyasztva szárítás) egy olyan eljárás, amely a szublimációt használja fel a víz eltávolítására a fagyasztott élelmiszerekből, így azok hosszú ideig eltarthatók maradnak.
Tudományos Kutatás
Az endoterm halmazállapot-változások tanulmányozása alapvető fontosságú a fizika, a kémia és a anyagtudományok területén. A különböző anyagok olvadáspontjának, forráspontjának és halmazállapot-változási hőinek ismerete elengedhetetlen az anyagok tulajdonságainak megértéséhez és új anyagok fejlesztéséhez.
Egyéb Alkalmazások
- A szárazjég szublimációját használják hűtésre és füstgépekben.
- A jég olvadását a gleccserek és a sarki jégtakarók olvadásában figyelhetjük meg, ami jelentős hatással van a környezetre.
Összefoglalás
Az endoterm halmazállapot-változások olyan folyamatok, amelyek során egy anyag alacsonyabb energiaszintű halmazállapotból magasabb energiaszintűbe kerül hőfelvétel révén. Ide tartozik az olvadás (szilárdból folyékonyba), a párolgás (folyékonyból gázba) és a szublimáció (szilárdból közvetlenül gázba). Mindhárom folyamathoz energia befektetésére van szükség a kötőerők legyőzéséhez. Ezek a jelenségek alapvetőek a természeti világban és számos technológiai alkalmazásban. A halmazállapot-változások energetikájának megértése kulcsfontosságú a különböző fizikai és kémiai rendszerek viselkedésének előrejelzéséhez és befolyásolásához.
További Tanulmányok
Ha mélyebben szeretne elmerülni az endoterm halmazállapot-változások témakörében, javasoljuk a termodinamika és a statisztikus mechanika alapjainak tanulmányozását. Ezek a területek részletes elméleti hátteret biztosítanak a halmazállapot-változások megértéséhez és kvantitatív leírásához.
Gyakran Ismételt Kérdések
Mi a különbség az endoterm és az exoterm folyamat között?
Az endoterm folyamatok hőt vesznek fel a környezetükből, míg az exoterm folyamatok hőt adnak le a környezetüknek.
Miért endoterm a párolgás?
A párolgás endoterm, mert energia szükséges a folyadékban lévő molekulák közötti vonzóerők legyőzéséhez, hogy a molekulák a gázfázisba kerülhessenek.