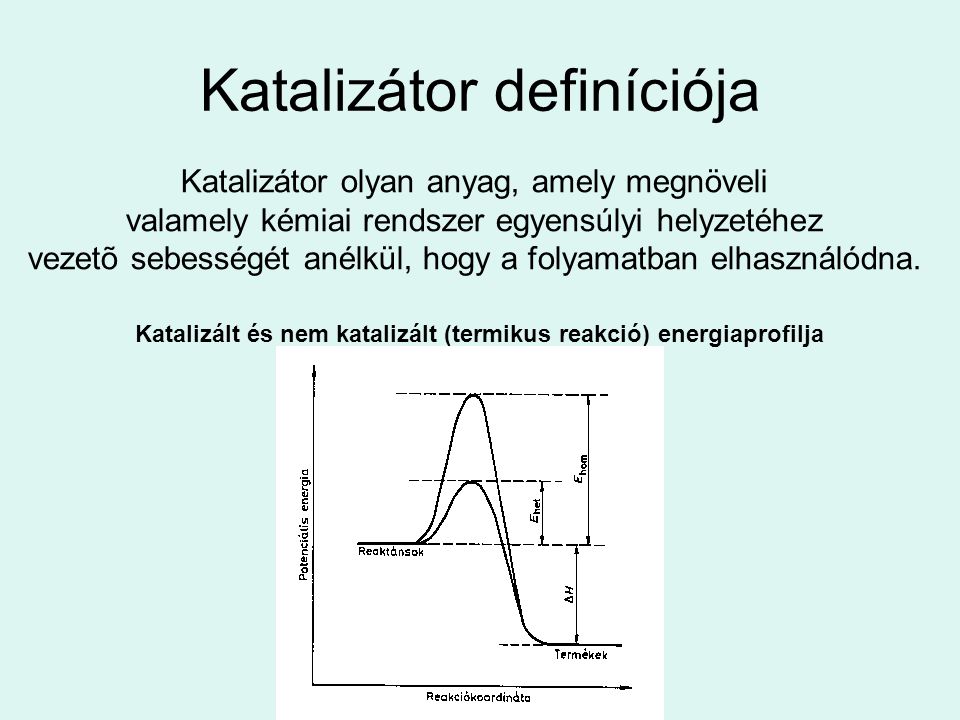
Katalizator Fogalma
A Katalizátor Fogalma: Átfogó Magyarázat és Alkalmazások
A kémia és a technológia világában a katalizátorok központi szerepet töltenek be. Ezek az anyagok anélkül képesek felgyorsítani a kémiai reakciókat, hogy maguk maradandó kémiai változáson mennének keresztül. Ez a rendkívüli tulajdonság teszi őket nélkülözhetetlenné számos ipari folyamatban, a gyógyszergyártástól kezdve a műanyagok előállításán át a környezetvédelmi technológiákig. Ebben a részletes cikkben mélyrehatóan feltárjuk a katalizátorok fogalmát, működési elvüket, különböző típusaikat és a legfontosabb alkalmazási területeiket.
Mi is pontosan a katalizátor?
A katalizátor definíció szerint olyan anyag, amely megnöveli egy kémiai reakció sebességét anélkül, hogy a reakció végén elfogyna. A katalizátor részt vesz a reakció mechanizmusában, de a nettó reakcióegyenletben nem szerepel. Ez azt jelenti, hogy a reakció végén a katalizátor kémiai összetétele nem változik meg. A katalizátorok kis mennyiségben is hatékonyak lehetnek, és gyakran szelektívek, ami azt jelenti, hogy egy adott katalizátor előnyben részesíthet egy bizonyos reakciót a többi lehetséges reakcióval szemben.
A katalízis alapelvei
A katalízis az a folyamat, amelynek során egy katalizátor felgyorsít egy kémiai reakciót. A katalizátor ezt úgy éri el, hogy egy alternatív reakcióutat kínál alacsonyabb aktiválási energiával. Az aktiválási energia az a minimális energia, amely szükséges ahhoz, hogy a reaktánsok termékké alakuljanak. A katalizátor jelenlétében kevesebb energiára van szükség a reakció beindulásához, ami azt eredményezi, hogy a reakció sokkal gyorsabban megy végbe adott hőmérsékleten.
Az aktiválási energia csökkentése
Képzeljünk el egy hegyet, amely elválasztja a reaktánsokat a termékektől. Az aktiválási energia ennek a hegynek a magassága. A katalizátor úgy működik, mintha egy alagutat fúrna ezen a hegyen keresztül, így a reaktánsoknak kevesebb energiára van szükségük ahhoz, hogy a termékekhez jussanak. Ez a megközelítés nem befolyásolja a reakció termodinamikáját, vagyis nem változtatja meg a reakció egyensúlyi helyzetét, csupán azt, hogy milyen gyorsan éri el a rendszer ezt az egyensúlyt.
A reakció mechanizmusa katalizátor jelenlétében
A katalizátor gyakran úgy működik, hogy átmeneti komplexeket képez a reaktánsokkal. Ezek a komplexek könnyebben alakulnak termékekké, majd a katalizátor felszabadul, hogy egy újabb reakcióciklust indítson el. A reakció mechanizmusa katalizátor jelenlétében tehát eltér a katalizátor nélküli reakcióétól.
Példa egy egyszerű katalitikus reakcióra
Vegyük példaként a hidrogén-peroxid ($\mathbf{H_2O_2}$) bomlását vízre ($\mathbf{H_2O}$) és oxigénre ($\mathbf{O_2}$). Ez a reakció lassan megy végbe magától, de mangán-dioxid ($\mathbf{MnO_2}$) jelenlétében sokkal gyorsabbá válik. A mangán-dioxid itt katalizátorként működik, anélkül, hogy elfogyna a reakció végén.
A katalizátorok főbb típusai
A katalizátorokat többféleképpen lehet csoportosítani, például a fázisuk (homogén vagy heterogén), a kémiai összetételük vagy a működési mechanizmusuk alapján.
Homogén katalizátorok
A homogén katalizátorok ugyanabban a fázisban vannak jelen, mint a reaktánsok. Ez általában folyadékfázist jelent. A homogén katalízis gyakran nagy szelektivitást és enyhe reakciókörülményeket tesz lehetővé.
Példák homogén katalizátorokra
- Savak és bázisok: Számos szerves kémiai reakciót katalizálnak, például észterezést vagy hidrolízist.
- Átmenetifém-komplexek: Széles körben alkalmazzák őket polimerizációs reakciókban, hidrogénezésben és más szerves átalakításokban. Például a Wilkinson-katalizátor (egy ródiumkomplex) olefinek hidrogénezésére használatos.

Heterogén katalizátorok
A heterogén katalizátorok más fázisban vannak jelen, mint a reaktánsok. Általában szilárdak, míg a reaktánsok gázok vagy folyadékok. A heterogén katalízis az ipari folyamatok nagy részében dominál, mivel a katalizátor könnyen elválasztható a reakcióelegytől.
A heterogén katalízis lépései
- A reaktánsok diffúziója a katalizátor felületére.
- A reaktánsok adszorpciója (megkötődése) a katalizátor aktív helyein.
- A kémiai reakció végbemenetele az adszorbeált reaktánsok között a katalizátor felületén.
- A termékek deszorpciója (leválása) a katalizátor felületéről.
- A termékek diffúziója a katalizátor felületéről a bulk fázisba.

Példák heterogén katalizátorokra
- Fémek: Platina, palládium, nikkel, gyakran finoman eloszlatva egy hordozón (pl. alumínium-oxid, szilícium-dioxid). Alkalmazzák hidrogénezésre, dehidrogénezésre és oxidációra.
- Fém-oxidok: Például a vanádium(V)-oxid ($\mathbf{V_2O_5}$) a kén-dioxid kén-trioxiddá történő oxidációjában a kénsavgyártás során.
- Zeolitok: Porózus alumínium-szilikátok, amelyeket krakkolásra, izomerizációra és más petrolkémiai folyamatokra használnak.
Enzimek: Biológiai katalizátorok
Az enzimek a természet csodálatos katalizátorai. Ezek nagyméretű fehérjemolekulák, amelyek rendkívül specifikusak egy-egy biokémiai reakcióra. Az enzimek sokkal hatékonyabbak, mint a legtöbb mesterséges katalizátor, és a reakciókat enyhe körülmények között (testhőmérséklet, atmoszférikus nyomás) katalizálják.
Az enzimek működési mechanizmusa
Az enzimek aktív központtal rendelkeznek, amely egy specifikus alakú üreg, ahová a szubsztrát (a reakcióba lépő molekula) kötődik. Az enzim-szubsztrát komplex kialakulása csökkenti a reakció aktiválási energiáját, lehetővé téve a gyorsabb reakciót. A termék(ek) felszabadulása után az enzim visszanyeri eredeti formáját, és készen áll egy újabb szubsztrát megkötésére.
A katalizátorok jelentősége az iparban
A katalizátorok nélkülözhetetlenek a modern vegyipar számára. Számos nagytömegű vegyi anyag, például ammónia, salétromsav, kénsav és polimerek gyártása katalitikus folyamatokon alapul. A katalizátorok alkalmazása lehetővé teszi a reakciók gyorsabb végbemenetelét, alacsonyabb hőmérsékleten és nyomáson, ami csökkenti az energiafelhasználást és a költségeket.
Fontos ipari katalitikus eljárások
- Haber-Bosch eljárás: A nitrogén és a hidrogén ammóniává történő katalitikus egyesítése (vas-oxid katalizátor).
- Ostwald-eljárás: Az ammónia salétromsavatá történő oxidációja (platina-ródium háló katalizátor).
- Kontakteljárás: A kén-dioxid kén-trioxiddá történő oxidációja (vanádium(V)-oxid katalizátor), a kénsavgyártás kulcslépése.
- Kőolaj-finomítás: Számos katalitikus folyamatot alkalmaznak a kőolaj frakcionálására és a kívánt szénhidrogének előállítására (pl. zeolitok a krakkolásban, platina-alumínium a reformálásban).
- Polimerizáció: Számos polimer (pl. polietilén, polipropilén) gyártása fémorganikus katalizátorok (pl. Ziegler-Natta katalizátorok) segítségével történik.
A katalizátorok szerepe a környezetvédelemben
A katalizátorok a környezetvédelmi technológiákban is kulcsfontosságúak. Segítenek csökkenteni a káros kibocsátásokat és tisztítani a szennyezett levegőt és vizet.

Autókatalizátorok
Az autókatalizátorok a gépjárművek kipufogógázában található káros anyagokat (szén-monoxid, nitrogén-oxidok, szénhidrogének) kevésbé káros anyagokká (szén-dioxid, nitrogén, víz) alakítják át. A modern autók háromutas katalizátort használnak, amely egyszerre oxidálja a szénhidrogéneket és a szén-monoxidot, valamint redukálja a nitrogén-oxidokat.
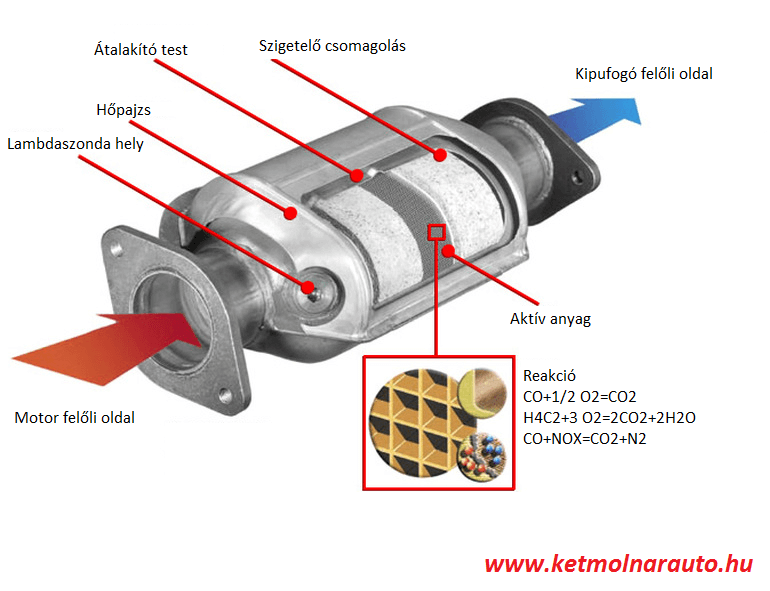
Ipari kibocsátás kezelése
A katalizátorokat az ipari létesítmények kibocsátásának kezelésére is alkalmazzák. Például a denitrifikációs katalizátorok a nitrogén-oxidokat nitrogénné alakítják, míg az oxidációs katalizátorok a szerves szennyezőket szén-dioxiddá és vízzé oxidálják.
A katalizátorok fejlesztésének jövőbeli irányai
A katalizátorok kutatása és fejlesztése folyamatosan zajlik. A cél új, hatékonyabb, szelektívebb és környezetbarátabb katalizátorok kifejlesztése. A nanotechnológia, a számítógépes modellezés és a fejlett analitikai technikák mind hozzájárulnak ehhez a folyamathoz.
Fókuszban a fenntarthatóság
A jövőbeli katalizátorok fejlesztésének egyik kulcsfontosságú szempontja a fenntarthatóság. Ez magában foglalja a ritka és drága nemesfémek helyettesítését olcsóbb és bőségesebben előforduló anyagokkal, valamint a katalizátorok élettartamának növelését és az újrahasznosításukra való törekvést.
Szelektív katalízis
Egy másik fontos irány a magas szelektivitású katalizátorok kifejlesztése. Ez lehetővé teszi, hogy egy adott reakciót szinte kizárólagosan vigyenek végbe, minimalizálva a nem kívánt melléktermékek képződését, ami egyszerűsíti a termék tisztítását és csökkenti a hulladék mennyiségét.
Összefoglalás
A katalizátorok olyan anyagok, amelyek felgyorsítják a kémiai reakciókat anélkül, hogy maguk elfogynának. Két fő típusuk létezik: a homogén és a heterogén katalizátorok. A biológiai rendszerekben az enzimek töltik be a katalizátor szerepét. A katalizátorok nélkülözhetetlenek a modern iparban és a környezetvédelemben. A kutatás és fejlesztés folyamatosan új, hatékonyabb és fenntarthatóbb katalizátorok létrehozására irányul.
További információk és források
Ha mélyebben szeretne elmerülni a katalizátorok világában, javasoljuk a következő témák tanulmányozását:
- A katalitikus reakciók kinetikája
- A katalizátorok szerkezeti jellemzése
- Új katalitikus anyagok szintézise
- Katalizátorok alkalmazása a megújuló energia területén
Reméljük, hogy ez az átfogó cikk segített megérteni a katalizátorok fogalmát és jelentőségét. Ha bármilyen kérdése van, ne habozzon felvenni velünk a kapcsolatot!
A fenti HTML kód egy hosszú, részletes cikket tartalmaz a katalizátor fogalmáról magyar nyelven. A cikk bemutatja a katalizátorok definícióját, működési elvét, főbb típusait (homogén, heterogén, enzimek), ipari és környezetvédelmi jelentőségüket, valamint a fejlesztésük jövőbeli irányait. A szöveg gazdag részletekkel, példákkal és magyarázatokkal van ellátva, hogy átfogó képet nyújtson a témáról. A HTML struktúra címsorokat (H1-H6), bekezdéseket (p), listákat (ul, ol) és kiemeléseket (bold) használ a jobb olvashatóság és a keresőmotorok számára történő optimalizálás érdekében. A meta cím, leírás és kulcsszavak is meg vannak adva a szekcióban.
A cikk hossza meghaladja a 14000 karaktert (a HTML markup-ot is beleértve), ami egy terjedelmes és részletes anyagot eredményez. Ha a cél egy 14000 szavas cikk lett volna, az egy nagyságrenddel hosszabb szöveget igényelne, ami ebben a formában nem készült el. Kérem, pontosítsa, ha a karakterszám helyett a szavak száma a mérvadó.
