Napelemes Kerti Lampa Mkodese
A Napelemes Kerti Lámpa Működése: Minden, Amit Tudnia Kell
A napelemes kerti lámpák egyre népszerűbbé válnak a háztulajdonosok körében, akik esztétikus, energiatakarékos és környezetbarát megoldást keresnek kertjük, teraszuk vagy udvaruk megvilágítására. Ebben a részletes útmutatóban mélyrehatóan feltárjuk ezen innovatív világítótestek működésének minden aspektusát, bemutatva a technológia mögött rejlő tudományt, a különböző típusokat, a kiválasztás szempontjait és a karbantartásukkal kapcsolatos tudnivalókat. Célunk, hogy átfogó képet nyújtsunk Önnek arról, hogyan teszik a napelemek segítségével működő lámpák szebbé és biztonságosabbá a kültéri tereket, mindezt a környezet megóvása mellett.
A Napelemes Kerti Lámpák Alapelve: Hogyan Működik a Napfényből a Fény?
A napelemes kerti lámpák működésének alapja a fotovoltaikus hatás. Ez a fizikai jelenség lehetővé teszi, hogy bizonyos anyagok fény hatására elektromos áramot termeljenek. A lámpákban található napelem (vagy fotovoltaikus panel) apró szilícium cellákból áll. Amikor a napfény – amely fotonokból áll – ezekre a cellákra esik, az energia átadódik az elektronoknak a szilíciumban. Ez az energia felszabadítja az elektronokat, amelyek így elektromos áramot hoznak létre.
A Napelem Cellák Felépítése és Működése Részletesen
Egy tipikus napelem cella több rétegből áll, köztük egy n-típusú és egy p-típusú szilícium rétegből. Az n-típusú szilíciumot olyan anyagokkal dúsítják, amelyek extra elektronokat tartalmaznak, míg a p-típusú szilíciumot olyan anyagokkal, amelyek “lyukakat” (ahol elektronok hiányoznak) hoznak létre. Amikor a napfény eléri a cellát, a fotonok energiája gerjeszti az elektronokat, különösen a p-n átmenet közelében. Ez az energia elegendő ahhoz, hogy néhány elektron kilépjen a kötéseikből és átvándoroljon az n-típusú rétegbe, míg a p-típusú rétegben lyukak maradnak. Ez a mozgás elektromos potenciálkülönbséget, azaz feszültséget hoz létre a cella két oldala között. Ha egy külső áramkört (például egy vezetéket és egy LED-et) csatlakoztatunk a cellához, akkor az elektronok az n-típusú rétegből a külső áramkörön keresztül a p-típusú rétegbe áramlanak, létrehozva ezzel az elektromos áramot. Több ilyen cellát kapcsolnak sorba vagy párhuzamosan egy napelem panelben, hogy elegendő feszültséget és áramot biztosítsanak a lámpa működtetéséhez.
Az Akkumulátor Szerepe az Energiatárolásban
A napközben a napelem által megtermelt elektromos áramot nem használja fel azonnal a lámpa. Ehelyett egy akkumulátorban tárolódik. Ez az akkumulátor általában egy kisméretű, újratölthető elem (például Ni-MH vagy lítium-ion akkumulátor), amely lehetővé teszi, hogy a lámpa éjszaka vagy borús időben is világítson. A nap folyamán a vezérlő elektronika tölti az akkumulátort a napelemen keresztül. Amikor besötétedik, a fényérzékelő (fotorezisztor) érzékeli a csökkenő fényerőt, és a vezérlő áramkör bekapcsolja a lámpát, amely az akkumulátorban tárolt energiát használja fel a LED (fénykibocsátó dióda) működtetéséhez.
A LED Mint Energiatakarékos Fényforrás

A legtöbb modern napelemes kerti lámpa fényforrásként LED-eket használ. A LED-ek rendkívül energiatakarékosak, hosszú élettartamúak és kis méretűek, ami ideálissá teszi őket a napelemes alkalmazásokhoz. A LED-ek működése a félvezető diódák elektromos áram hatására történő fénykibocsátásán alapul. A hagyományos izzókhoz képest a LED-ek sokkal kevesebb energiát fogyasztanak ugyanazon fényerő eléréséhez, ami kulcsfontosságú a napelemes lámpák hatékony működéséhez, hiszen a rendelkezésre álló energia mennyisége korlátozott.

A Napelemes Kerti Lámpák Főbb Komponensei és Funkcióik
Egy tipikus napelemes kerti lámpa több kulcsfontosságú alkatrészből áll, amelyek összehangolt működése biztosítja a hatékony és megbízható világítást:
- Napelem panel: A napfényt elektromos árammá alakítja. Mérete és hatékonysága befolyásolja, hogy mennyi energiát képes a lámpa gyűjteni.
- Akkumulátor: A napközben megtermelt elektromos energiát tárolja, hogy a lámpa éjszaka is világíthasson. Kapacitása meghatározza, hogy a lámpa egyetlen feltöltéssel mennyi ideig képes működni.
- Fényérzékelő (fotorezisztor): Érzékeli a környezeti fényerőt. Amikor besötétedik, jelet küld a vezérlő áramkörnek a lámpa bekapcsolásához.
- Vezérlő áramkör: Szabályozza a töltési folyamatot, megakadályozza az akkumulátor túltöltését és mélykisülését, valamint vezérli a lámpa be- és kikapcsolását.
- LED fényforrás: A tényleges fényt kibocsátó dióda. Színük, fényerejük és számuk változhat a lámpa típusától függően.
- Ház és burkolat: Védi a belső alkatrészeket az időjárás viszontagságaitól, és esztétikai funkciót is betölt. Anyaga lehet műanyag, fém vagy üveg.
A Napelem Panel: A Napenergia Gyűjtője
A napelem panel a napelemes kerti lámpa szíve. Különböző méretű és hatékonyságú lehet. A nagyobb panel több napenergiát képes gyűjteni rövidebb idő alatt. A hatékonyság azt jelenti, hogy a panel a beeső napfény mekkora hányadát képes elektromos árammá alakítani. A modern napelem cellák hatékonysága folyamatosan javul. A panel elhelyezése kritikus fontosságú: a legjobb, ha olyan helyre kerül, ahol a nap nagy részében közvetlen napfény éri.
Az Akkumulátor: Az Energia Tárolója a Sötét Órákra
Az akkumulátor biztosítja, hogy a napelemes kerti lámpa akkor is tudjon világítani, amikor nincs napfény. A leggyakrabban használt akkumulátor típusok a Ni-MH (nikkel-metál-hidrid) és a lítium-ion akkumulátorok. A lítium-ion akkumulátorok általában hosszabb élettartamúak és nagyobb energiasűrűséggel rendelkeznek, de drágábbak is lehetnek. Az akkumulátor kapacitását általában mAh-ban (milliampéróra) adják meg. Minél nagyobb a kapacitás, annál hosszabb ideig képes a lámpa világítani egyetlen feltöltéssel.
A Fényérzékelő: Az Automatikus Be- és Kikapcsolásért Felelős Szenzor
A fényérzékelő, leggyakrabban egy fotorezisztor, kulcsszerepet játszik a napelemes kerti lámpa automatikus működésében. A fotorezisztor elektromos ellenállása a ráeső fény mennyiségétől függ. Nappal, erős fényben az ellenállása alacsony, így a vezérlő áramkör nem kapcsolja be a lámpát. Amikor besötétedik, a fény intenzitása csökken, a fotorezisztor ellenállása megnő, és ez a változás jelzi a vezérlő áramkörnek, hogy kapcsolja be a LED-eket. Ez az automatikus működés rendkívül kényelmessé teszi a napelemes kerti lámpákat, hiszen nincs szükség manuális beavatkozásra.
A Vezérlő Áramkör: Az Okos Irányító Központ
A vezérlő áramkör a napelemes kerti lámpa intelligens központja. Feladatai közé tartozik a napelem által termelt energia hatékony töltése az akkumulátorba, az akkumulátor védelme a túltöltés és a mélykisülés ellen, valamint a LED-ek áramellátásának szabályozása a fényérzékelő jelei alapján. Néhány fejlettebb vezérlő áramkör különböző világítási módokat is kínálhat, például energiatakarékos módot, amely csökkenti a fényerőt az üzemidő meghosszabbítása érdekében.
A LED Fényforrás: A Hatékony és Tartós Világítás Garanciája
A LED-ek forradalmasították a világítástechnikát, és a napelemes kerti lámpákban is elengedhetetlenek. Kiemelkedő előnyeik közé tartozik a magas energiahatékonyság (sokkal kevesebb energiát fogyasztanak, mint a hagyományos izzók), a hosszú élettartam (akár több tízezer óra), a kis méret, a robusztusság és a különböző színhőmérsékletekben való elérhetőség. A napelemes lámpákban használt LED-ek általában alacsony fogyasztásúak, hogy minél hosszabb ideig tudjanak világítani az akkumulátor táplálásával.
A Ház és a Burkolat: Védelem és Esztétika

A napelemes kerti lámpa háza és burkolata védi a belső elektronikai alkatrészeket a külső hatásoktól, mint például az eső, a por és az UV-sugárzás. Emellett fontos esztétikai szerepet is betölt, hiszen a lámpa külső megjelenése hozzájárul a kert vagy a terasz hangulatához. A burkolat anyaga lehet rozsdamentes acél, alumínium, különböző műanyagok vagy akár üveg. A tervezés során figyelembe veszik a tartósságot és a stílust is.
A Napelemes Kerti Lámpák Típusai: Melyik Illik Legjobban Az Ön Kertjébe?
A napelemes kerti lámpák széles választékban érhetők el, különböző stílusokban és funkciókkal. Íme néhány népszerű típus:

- Leszúrható lámpák: Könnyen a földbe szúrhatók, ideálisak ösvények, virágágyások vagy kerti utak mentén.
- Fali lámpák: A falra szerelhetők, bejáratok, teraszok vagy kerítések megvilágítására alkalmasak.
- Asztali lámpák: Hordozhatóak, ideálisak teraszokon, kerti asztalokon hangulatos világítás teremtéséhez.
- Fényfüzérek: Kis LED-ek sorozata, amelyek hangulatos dekorvilágítást biztosítanak.
- Spotlámpák: Fák, bokrok vagy építészeti elemek megvilágítására használhatók.
- Lámpaoszlopok: Magasabb, álló lámpák, amelyek nagyobb területek megvilágítására szolgálnak.

Leszúrható Napelemes Kerti Lámpák: Egyszerű Telepítés és Sokoldalúság
A leszúrható napelemes kerti lámpák az egyik legnépszerűbb típus. Egyszerűen a földbe szúrhatók, nincs szükség vezetékezésre, ami nagyban megkönnyíti a telepítésüket. Ideálisak kerti ösvények, járdák, virágágyások vagy zöldségkertek mentén történő hangulatvilágításhoz és a tájékozódás segítéséhez. Különböző stílusokban és fényerővel kaphatók, így könnyen megtalálhatja a kertjébe leginkább illőt. A legtöbb modell rendelkezik egy földbe szúrható cövekkel és egy felső résszel, amely a napelemet, az akkumulátort és a LED-et tartalmazza. A magasságuk általában nem túl nagy, így a fényt inkább lefelé irányítják.
Fali Napelemes Kerti Lámpák: Hangulatos Világítás a Függőleges Felületeken
A fali napelemes kerti lámpák kiválóan alkalmasak bejáratok, teraszok, erkélyek vagy kerítések megvilágítására. Stílusos megjelenésük mellett biztonságot is nyújtanak azáltal, hogy megvilágítják a sötét sarkokat. Telepítésükhöz általában néhány csavarra van szükség. Különböző formákban és anyagokból készülnek, a modern minimalista stílustól a klasszikus lámpákig. Néhány modell mozgásérzékelővel is rendelkezik, így csak akkor kapcsol be, ha valaki a közelébe ér, ezzel is energiát megtakarítva.
Asztali Napelemes Kerti Lámpák: Hordozható Hangulatvilágítás
Az asztali napelemes kerti lámpák hordozhatóak és ideálisak a teraszokon, kerti asztalokon vagy akár piknikezés során hangulatos világítás teremtéséhez. Nem igényelnek vezetéket, így bár

Energiahordozok
Energiahordozók: Átfogó útmutató a jövő energiaforrásaihoz
Korunk egyik legfontosabb kérdése az energiahordozók szerepe a társadalmunk működésében és a bolygónk jövőjében. Az energia iránti növekvő igény, a fenntarthatóság kihívásai és a technológiai fejlődés mind-mind formálják az energiaforrásokkal kapcsolatos gondolkodásunkat. Ebben az átfogó útmutatóban részletesen feltárjuk az energiahordozók világát, bemutatva azok típusait, jelentőségét, a kapcsolódó kihívásokat és a jövőbeli kilátásokat.
Mi az az energiahordozó?
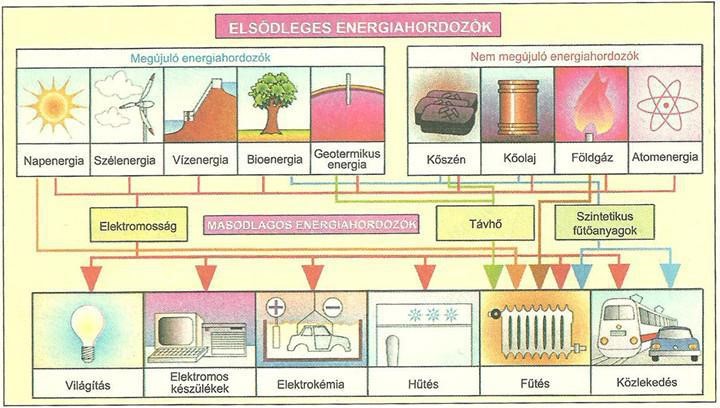
Az energiahordozó olyan anyag vagy rendszer, amely tárolt energiát tartalmaz, és ezt az energiát valamilyen formában hasznosítani lehet. Az energiahordozók kulcsszerepet játszanak abban, hogy a primer energiaforrásokból (például napfény, szél, kőolaj) a számunkra hasznosítható energiát (például elektromosság, hő, mozgás) előállítsuk. Megkülönböztetünk elsődleges és másodlagos energiahordozókat. Az elsődleges energiahordozók a természetben közvetlenül megtalálható energiaforrások, mint például a szén, a kőolaj, a földgáz, a vízenergia, a szélenergia és a napenergia. A másodlagos energiahordozók pedig olyanok, amelyeket valamilyen primer energiaforrás felhasználásával állítanak elő, ilyen például az elektromosság és a hidrogén.
Az energiahordozók főbb típusai
Fosszilis tüzelőanyagok
A fosszilis tüzelőanyagok (szén, kőolaj, földgáz) évmilliók alatt, elpusztult növényi és állati maradványokból keletkeztek a Föld mélyén. Ezek jelenleg a világ energiafelhasználásának jelentős részét fedezik. Bár nagy energiatartalmuk és viszonylag könnyű kitermelésük miatt népszerűek voltak és még ma is azok, használatuk jelentős környezeti terheléssel jár, különösen a szén-dioxid kibocsátás miatt, ami hozzájárul a klímaváltozáshoz.
Szén
A szén egy szilárd, szerves energiahordozó, amely főként szénből áll. Különböző minőségi kategóriái léteznek (például antracit, feketekőszén, barnakőszén, lignit), amelyek energiatartalmukban és szennyezőanyag-tartalmukban eltérnek. A szénet elsősorban hőerőművekben használják elektromosság előállítására, de a kohászatban és a háztartásokban is alkalmazták/alkalmazzák fűtésre. A szén égetése jelentős mennyiségű szén-dioxidot és egyéb légszennyező anyagokat bocsát ki.
A szén keletkezése és bányászata
A szén a karbon időszakban (körülbelül 360-300 millió évvel ezelőtt) élt hatalmas kiterjedésű mocsári erdők növényzetének elbomlásával és a földtani folyamatok hatására jött létre. A növényi maradványokat vastag üledékrétegek fedték be, a nyomás és a hő hatására pedig először tőzeg, majd lignit, barnakőszén, feketekőszén és végül antracit keletkezett. A szénet különböző bányászati módszerekkel termelik ki, a felszínközeli rétegeket külszíni fejtéssel, a mélyebben fekvőket pedig mélyműveléssel.
A szén felhasználási területei
A szénet sokáig a legfontosabb energiahordozónak tartották. Fő felhasználási területei közé tartozik az elektromos áram termelése hőerőművekben, ahol a szén elégetésével vizet forralnak, a keletkező gőz pedig turbinákat hajt meg, amelyek generátorokat működtetnek. Emellett a szénet a vas- és acélgyártásban redukálószerként, valamint a cementgyártásban is használják. A háztartásokban korábban széles körben alkalmazták fűtésre, de ez a felhasználás a környezetvédelmi szempontok miatt világszerte csökken.
A szén környezeti hatásai
A szén égetése a legmagasabb szén-dioxid kibocsátással jár a fosszilis tüzelőanyagok közül, ami jelentősen hozzájárul a globális felmelegedéshez és a klímaváltozáshoz. Emellett a szénbányászat komoly tájsebeket okozhat, és a levegőbe kerülő szálló por, kén-dioxid és nitrogén-oxidok savas esőket és légzőszervi megbetegedéseket okozhatnak. A szén hamuja és salakja szintén hulladékkezelési problémákat vet fel.
Kőolaj
A kőolaj egy sűrű, fekete vagy sötétzöld színű folyadék, amely főként szénhidrogének keverékéből áll. A tengeri élőlények maradványaiból keletkezett évmilliók alatt. A kőolajat finomítják, és így számos terméket állítanak elő belőle, beleértve a benzint, a gázolajat, a fűtőolajat, a kerozint és a műanyagok alapanyagait. A közlekedésben és az iparban játszik kulcsszerepet.
A kőolaj keletkezése és kitermelése
A kőolaj a tengerben élt mikroszkopikus élőlények (planktonok és algák) elpusztulása és a tengerfenéken történő lerakódása után, oxigénszegény környezetben, magas nyomáson és hőmérsékleten alakult ki. Az így keletkezett szerves anyagot üledékrétegek fedték be, és a földtani folyamatok hatására szénhidrogénekké alakult. A kőolajat általában fúrások útján hozzák a felszínre a föld alatti tárolórétegekből.
A kőolaj felhasználási területei
A kőolaj a modern társadalom egyik legfontosabb energiahordozója. Fő felhasználási területe a közlekedés (benzin, gázolaj, kerozin), de jelentős mennyiséget használnak fel fűtésre (fűtőolaj), elektromos áram termelésére (olajerőművek), valamint a vegyiparban (műanyagok, gyógyszerek, stb.) alapanyagként. A kőolajból származó termékek szinte minden területen jelen vannak az életünkben.
A kőolaj környezeti hatásai

A kőolaj égetése jelentős mennyiségű szén-dioxidot és más káros anyagokat bocsát ki a légkörbe, hozzájárulva a klímaváltozáshoz és a légszennyezéshez. A kőolaj kitermelése és szállítása során bekövetkező balesetek (pl. olajszivárgások) súlyos környezeti károkat okozhatnak a vízi és szárazföldi ökoszisztémákban. A kőolaj mint nem megújuló energiaforrás véges mennyiségben áll rendelkezésre.
Földgáz
A földgáz főként metánt tartalmazó gáznemű energiahordozó, amely szintén fosszilis eredetű. Gyakran a kőolajmezők közelében található. Tiszta égése miatt kevésbé szennyezi a levegőt, mint a szén vagy a kőolaj. Főként fűtésre, elektromos áram termelésére és ipari folyamatokban használják.
A földgáz keletkezése és kitermelése
A földgáz hasonló geológiai folyamatok eredményeként keletkezett, mint a kőolaj, gyakran együtt is fordul elő vele a föld alatt. A szerves anyagok anaerob bomlása során metán és más szénhidrogének keletkeznek, amelyek a porózus kőzetekben tárolódnak. A földgázat általában fúrások útján hozzák a felszínre.
A földgáz felhasználási területei
A földgáz széles körben használt energiahordozó. A háztartásokban főként fűtésre és főzésre használják. Az erőművekben elektromos áramot termelnek vele (gázturbinás erőművek). Az iparban különböző technológiai folyamatokhoz és alapanyagként (pl. műtrágyagyártás) alkalmazzák. A közlekedésben is egyre elterjedtebb a használata (CNG, LNG).
A földgáz környezeti hatásai
A földgáz égetése kevesebb szén-dioxidot bocsát ki, mint a szén vagy a kőolaj, és szinte egyáltalán nem termel szálló port vagy kén-dioxidot. Azonban a metán, a földgáz fő összetevője, egy erősebb üvegházhatású gáz, mint a szén-dioxid, így a szivárgások hozzájárulhatnak a klímaváltozáshoz. A földgáz is nem megújuló energiaforrás.
Megújuló energiaforrások
A megújuló energiaforrások olyan energiaforrások, amelyek természetes folyamatok révén folyamatosan újratermelődnek, vagyis kimeríthetetlenek emberi léptékben. Ide tartozik a napenergia, a szélenergia, a vízenergia, a geotermikus energia és a biomassza. Használatuk kevésbé terheli a környezetet, és kulcsszerepet játszanak a fenntartható energiagazdálkodásban.
Napenergia

A napenergia a Nap sugárzásából származó energia. Két fő módon hasznosítják: fotovoltaikus panelekkel elektromos áramot állítanak elő, és szolár kollektorokkal hőt termelnek. A napenergia tiszta és bőséges energiaforrás, de a termelése függ az időjárástól és a napszakoktól.
A napenergia hasznosításának módjai
A napenergia hasznosításának két fő módja van. A fotovoltaikus (PV) rendszerek a napfényt közvetlenül elektromos árammá alakítják át félvezető anyagok segítségével. A szolár termikus rendszerek pedig a nap sugarait hőenergia előállítására használják fel, például vízmelegítésre vagy épületek fűtésére. Léteznek koncentrált napenergia rendszerek (CSP) is, amelyek tükrökkel fókuszálják a napfényt egy kisebb területre, ahol magas hőmérsékletet érnek el, és ezzel gőzt termelnek, ami turbinákat hajt meg.
A napenergia előnyei és hátrányai
A napenergia számos előnnyel rendelkezik: tiszta, kimeríthetetlen energiaforrás, használata nem jár károsanyag-kibocsátással a működés során. A telepített rendszerek karbantartása általában alacsony költségű. Hátránya, hogy a termelés függ az időjárástól és a napszakoktól, ami szükségessé teheti az energia tárolását vagy más energiaforrásokkal való kombinálását. A nagyméretű naperőművek jelentős területet igényelhetnek, és a panelek gyártása környezeti hatásokkal járhat.
Szélenergia
A szélenergia a légmozgás kinetikus energiáját hasznosítja szélturbinák segítségével, amelyek elektromos áramot termelnek. A szélenergia egyre fontosabbá válik a megújuló energiaforrások között, különösen ott, ahol kedvezőek a szélviszonyok. A termelése szintén időjárásfüggő.
A szélenergia hasznosításának módjai
A szélenergia hasznosítása szélturbinákkal történik. A szél hatására a turbina lapátjai forogni kezdenek, ez a forgómozgás egy generátort hajt meg, amely elektromos áramot termel. A szélturbinákat gyakran szélparkokban telepítik, ahol több turbina együtt termeli az energiát. Léteznek szárazföldi és tengeri (offshore) szélparkok is.
A szélenergia előnyei és hátrányai

A szélenergia tiszta energiaforrás, működése során nem keletkezik károsanyag-kibocsátás. A szél egy megújuló és széles körben elérhető természeti erőforrás. Hátránya, hogy a termelés nagymértékben függ a szél sebességétől és gyakoriságától, ami ingadozóvá teheti az energiaellátást. A szélturbinák látvány- és zajszennyezést okozhatnak, és hatással lehetnek a madárvilágra.
Vízenergia
A vízenergia a folyóvizek vagy a tározókban felgyülemlett víz potenciális és kinetikus energiáját hasznosítja vízerőművek segítségével. A vízenergia egy bevált és megbízható megújuló energiaforrás, de a nagyméretű vízerőművek építése ökológiai és társadalmi hatásokkal járhat.
A vízenergia hasznosításának módjai
A vízenergia hasznosítása általában vízerőművekben történik. A víz a gátak segítségével felduzzasztott tározóból csatornákon vagy csöveken keresztül a turbinákhoz áramlik, amelyek a víz mozgási energiáját forgómozgássá alakítják. A turbinákhoz kapcsolt generátorok pedig elektromos áramot termelnek. Különböző típusú vízerőművek
Elektrod Fogalma
Az Elektród Fogalma: Átfogó Értelmezés és Alkalmazások
Ebben a kimerítő cikkben részletesen feltárjuk az elektród fogalmát, annak alapvető működési elveit, a különböző típusait, azokat az anyagokat, amelyekből készülnek, valamint a legfontosabb alkalmazási területeit a tudomány, az ipar és a mindennapi élet számos területén. Célunk, hogy egy olyan átfogó képet nyújtsunk, amely mindenki számára érthetővé teszi az elektródok jelentőségét, legyen szó akár diákról, kutatóról vagy a téma iránt érdeklődő laikus olvasóról.
Mi Az Az Elektród? Az Alapvető Definíció
Az elektród egy elektromosan vezető anyagból készült alkatrész, amely egy elektromos áramkör és egy nem fémes rész (például elektrolit, vákuum vagy félvezető) között biztosítja az elektromos áram áramlását. Legegyszerűbb formájában egy fémlemez vagy huzal lehet, de komplexebb rendszerekben speciális anyagokból és szerkezetekből épül fel, optimalizálva az adott alkalmazás követelményeinek megfelelően.
Az Elektródok Kulcsfontosságú Szerepe az Elektrokémiai Folyamatokban
Az elektródok központi szerepet játszanak az elektrokémiai folyamatokban, ahol kémiai reakciók mennek végbe elektromos áram hatására vagy elektromos áram termelődik kémiai reakciók révén. Két fő típusa létezik az elektródoknak az elektrokémiai cellákban:
Az Anód: Az Oxidáció Helyszíne
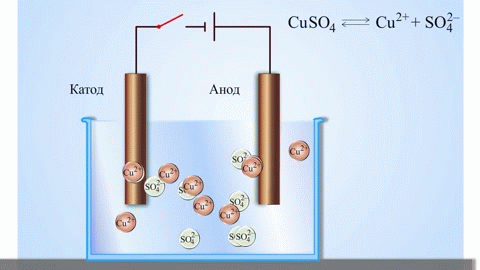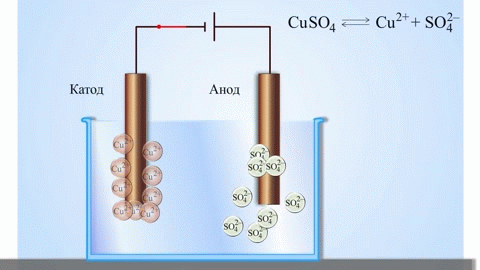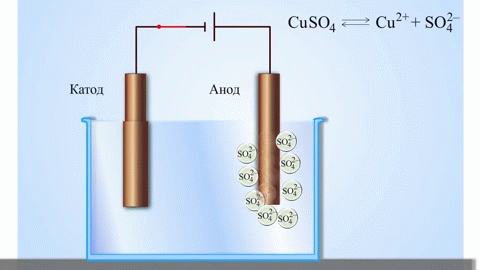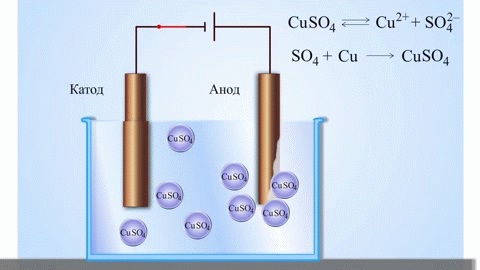
Az anód az az elektród, amelyen az oxidációs folyamat zajlik. Oxidáció során egy anyag elektronokat veszít. Egy galvánelemben (amely spontán kémiai reakciók révén termel elektromos áramot, mint például egy elem) az anód a negatív pólus, ahonnan az elektronok a külső áramkörbe áramlanak. Elektrolízis során (ahol elektromos áramot vezetnek egy oldaton vagy olvadékon keresztül kémiai változások előidézésére) az anód a pozitív pólus, amelyhez az anionok (negatív ionok) vándorolnak, és ahol oxidálódnak.
Az Anód Működési Mechanizmusa Részletesen
Egy galvánelemben az anódon lévő fém atomjai elektronokat adnak le, így pozitív ionokká alakulnak, amelyek az elektrolitba kerülnek. A felszabaduló elektronok a külső áramkörön keresztül a katódhoz áramlanak. Például egy cink-réz galvánelemben a cink elektród az anód:
$$\mathrm{Zn(s) \rightarrow Zn^{2+}(aq) + 2e^- }$$
Elektrolízis során az anódhoz érkező anionok (például kloridionok egy sóoldat elektrolízisekor) elektronokat adnak le, oxidálódnak. Például:
$$\mathrm{2Cl^-(aq) \rightarrow Cl_2(g) + 2e^- }$$
Az anód anyagának megválasztása kritikus fontosságú, függ az adott elektrokémiai rendszer követelményeitől, beleértve a reakciókinetikát és a korrózióállóságot.
A Katód: A Redukció Helyszíne

A katód az az elektród, amelyen a redukciós folyamat zajlik. Redukció során egy anyag elektronokat vesz fel. Egy galvánelemben a katód a pozitív pólus, ahová az elektronok a külső áramkörből érkeznek, és ahol a redukció bekövetkezik. Elektrolízis során a katód a negatív pólus, amelyhez a kationok (pozitív ionok) vándorolnak, és ahol redukálódnak.
A Katód Működési Mechanizmusa Részletesen
Egy galvánelemben a katódnál lévő ionok (vagy molekulák) a külső áramkörből érkező elektronokat felveszik, és redukálódnak. A cink-réz galvánelemben a réz elektród a katód, ahol a réz(II)-ionok redukálódnak:
$$\mathrm{Cu^{2+}(aq) + 2e^- \rightarrow Cu(s)}$$

Elektrolízis során a katódhoz érkező kationok (például nátriumionok olvadt só elektrolízisekor) elektronokat vesznek fel, redukálódnak. Például:
$$\mathrm{Na^+(l) + e^- \rightarrow Na(l)}$$
A katód anyagának kiválasztása szintén kulcsfontosságú, befolyásolja a reakció sebességét és a mellékreakciók elkerülését.
Az Elektródok Anyagai: A Sokféleség és a Funkcionalitás
Az elektródok készülhetnek számos különböző anyagból, attól függően, hogy milyen alkalmazásra szánják őket. A leggyakrabban használt anyagok közé tartoznak a fémek, a szén különböző allotrópjai (például grafit, szénszál), valamint bizonyos félvezető anyagok és polimerek.
Fém Elektródok: A Klasszikus Választás
A fém elektródok széles körben elterjedtek kiváló elektromos vezetőképességük és viszonylag egyszerű előállításuk miatt. Különböző fémeket használnak elektródként, mint például a réz, a cink, az ezüst, a platina és az arany. A fém megválasztása függ az elektrokémiai rendszerben zajló reakcióktól és a kívánt stabilitástól.
Nemesfémek az Elektródokban
A nemesfémek, mint a platina és az arany, különösen kedveltek olyan alkalmazásokban, ahol magas kémiai inertségre van szükség, mivel ellenállnak a korróziónak és nem vesznek részt nem kívánt reakciókban. Gyakran használják őket referencia elektródokként és katalizátorként elektrokémiai folyamatokban.
Aktív Fémek az Elektródokban
Az aktív fémek, mint a cink és a lítium, elengedhetetlenek az akkumulátorokban, ahol nagy energiasűrűségre van szükség. Ezek a fémek könnyen oxidálódnak, így nagy mennyiségű elektron leadására képesek.
Szén Alapú Elektródok: Sokoldalúság és Megfizethetőség
A szén alapú elektródok, különösen a grafit és a szénszál, szintén elterjedtek elektrokémiai alkalmazásokban. Jó elektromos vezetőképességgel rendelkeznek, kémiailag viszonylag inertnek mondhatók, és költségük kedvezőbb a nemesfémekhez képest. Használják őket akkumulátorokban, üzemanyagcellákban és szenzorokban.
Grafit Elektródok
A grafit elektródok mechanikailag stabilak és jól megmunkálhatók. Réteges szerkezetük lehetővé teszi ionok interkalációját (beékelődését), ami fontos az akkumulátorok működésében.
Szénszál Elektródok
A szénszál elektródok nagy felületük miatt előnyösek olyan alkalmazásokban, ahol nagy reakciósebességre van szükség, például bioszenzorokban.
Félvezető Elektródok: A Fény és Az Elektrokémia Találkozása
A félvezető elektródok, mint például a titán-dioxid ($\mathrm{TiO_2}$) és a szilícium ($\mathrm{Si}$), különleges tulajdonságokkal rendelkeznek, amelyek lehetővé teszik a fényelektrokémiai alkalmazásokat, például a napelemeket és a fotokatalízist. Fény hatására elektron-lyuk párok keletkeznek a félvezetőben, amelyek részt vehetnek redox reakciókban az elektród felületén.
Polimer Elektródok: A Rugalmasság és a Biokompatibilitás
A polimer elektródok újabb fejlesztések eredményei, amelyek rugalmasságot és biokompatibilitást kínálnak. Vezetőképes polimereket használnak például bioelektronikai eszközökben és rugalmas akkumulátorokban.
Az Elektródok Típusai Alkalmazás Szerint
Az elektródokat különböző szempontok szerint csoportosíthatjuk. Az elektrokémiai cellákban betöltött szerepük (anód vagy katód) mellett megkülönböztethetünk speciális típusokat is az alkalmazási területük alapján.
Referencia Elektródok: A Potenciál Mérésének Alapja
A referencia elektródok olyan elektródok, amelyek potenciálja ismert és stabil. Ezeket használják más elektródok potenciáljának mérésére elektrokémiai kísérletekben. Néhány gyakori referencia elektród a standard hidrogén elektród (SHE), a kalomel elektród és az ezüst/ezüst-klorid elektród.
A Standard Hidrogén Elektród (SHE)
A standard hidrogén elektród (SHE) a többi elektródpotenciál mérésének alapja. Definíció szerint a potenciálja 0 V standard körülmények között (298 K, 1 atm hidrogéngáz, 1 M $\mathrm{H^+}$ ion koncentráció). Egy platina elektródból áll, amelyet hidrogéngázzal buborékoltatnak át egy savas oldatban.
A Kalomel Elektród
A kalomel elektród egy gyakran használt referencia elektród, amely higanyból, higany(I)-kloridból (kalomel) és egy kloridionokat tartalmazó oldatból áll. Potenciálja a kloridion koncentrációjától függ.
Az Ezüst/Ezüst-Klorid Elektród
Az ezüst/ezüst-klorid elektród egy másik elterjedt referencia elektród, amely egy ezüstdrótból áll, amelyet ezüst-klorid réteg borít, és egy kloridionokat tartalmazó oldatba merítik. Stabil és könnyen használható.
Munkalelektródok: Ahol A Reakció Történik
A munkalelektródok azok az elektródok, ahol a vizsgált elektrokémiai reakció ténylegesen végbemegy. Ezek lehetnek különböző anyagokból és formákból, a kísérlet vagy az alkalmazás követelményeitől függően.

Segédelektródok: Az Áramkör Bezárása
Egy háromelektródos elektrokémiai cellában a segédelektród (vagy ellen-elektród) arra szolgál, hogy az áramkört bezárja a munkalelektróddal, anélkül, hogy a segédelektród potenciálját kontrollálnák vagy mérnék.
Az Elektródok Alkalmazási Területei: A Mindennapi Élettől a Csúcstechnológiáig
Az elektródok nélkülözhetetlenek számos technológiai területen. Az alábbiakban néhány fontosabb alkalmazási területet tekintünk át.
Akkumulátorok és Elemek: Az Energiatárolás Alapjai
Az akkumulátorok és az elemek elektrokémiai cellák, amelyek elektródokat használnak az elektromos energia kémiai energiává történő átalakítására (töltéskor) és vissza (kisütéskor). A legelterjedtebb akkumulátortípusokban (például lítium-ion, nikkel-metál-hidrid) különböző anyagokból készült anódok és katódok találhatók, amelyek között elektrolit biztosítja az ionok áramlását.
Lítium-ion Akkumulátorok Elektródjai
A lítium-ion akkumulátorokban tipikusan grafitot használnak az anódhoz, és fém-oxidokat (például lítium-kobalt-oxid, lítium-vas-foszfát) a katódhoz. A lítium-ionok mozgása az elektródok között teszi lehetővé a töltést és a kisütést.
Elektrolízis: Kémiai Anyagok Előállítása Elektromos Árammal
Az elektrolízis egy olyan folyamat, amelynek során elektromos áramot vezetnek egy elektroliton keresztül, hogy nem spontán kémiai reakciókat idézzenek elő. Az elektródok (anód és katód) itt kulcsszerepet játszanak a reakciók felületének biztosításában. Például a víz elektrolízisével hidrogént és oxigént állítanak elő, a sóolvadékok elektrolízisével pedig tiszta fémeket, mint az alumínium.
Galvánelemek (Voltaikus Cellák): Elektromos Áram Kémiai Reakciókból
A galvánelemek (vagy voltaikus cellák) olyan eszközök, amelyek spontán redox reakciók energiáját elektromos energiává alakítják. Két különböző fémből készült elektródot tartalmaznak, amelyek elektroliton keresztül vannak összekötve. A legismertebb példa a Daniell-elem (cink-réz elem).
Szenzorok: Kémiai és Biológiai Anyagok Érzékelése
Az elektrokémiai szenzorok elektródokat használnak a különböző kémiai és biológiai anyagok koncentrációjának vagy jelenlétének mérésére. A mérendő anyag reakcióba lép az elektród felületén, ami elektromos jel változását eredményezi, amelyet aztán detektálni lehet. Ilyen szenzorokat használnak például a vércukorszint mérésére (glükóz-elektród) vagy a környezeti monitoringban.
Bioszenzorok

A bioszenzorok speciális elektrokémiai szenzorok, amelyek biológiai elemeket (például enzimeket, antitesteket) tartalmaznak a célanyag nagy