Ken Vegyuletei
A Kén Vegyületei: Átfogó Útmutató Tulajdonságaikhoz és Felhasználásukhoz
A kén a periódusos rendszer tizenhatodik eleme, egy nemfém, amely számos különböző vegyületet képez más elemekkel. Ezek a kénvegyületek kulcsszerepet játszanak a természetben, az iparban és a mindennapi életünkben. Ebben az átfogó útmutatóban részletesen feltárjuk a kén legfontosabb vegyületeinek tulajdonságait, előfordulását, előállítását és sokrétű felhasználási területeit.
A Kén Alapvető Tulajdonságai
A tiszta kén szobahőmérsékleten szilárd, sárga színű anyag. Több allotrop módosulata létezik, melyek közül a legstabilabb a rombos kén. A kén olvadáspontja viszonylag alacsony (kb. 115 °C), forráspontja pedig 445 °C körül van. Kémiailag reaktív elem, különösen magasabb hőmérsékleten számos más elemmel lép reakcióba.
A Kén Elektronszerkezete és Oxidációs Állapotai
A kén elektronszerkezete \[Ne\] 3s^2 3p^4. Külső elektronhéján hat elektron található, ezért a vegyületeiben leggyakrabban -2, +2, +4 és +6 oxidációs állapotokat vesz fel. Ez a változatos oxidációs állapot teszi lehetővé a kén számára, hogy rendkívül sokféle vegyületet képezzen.
A Kén Legfontosabb Anorganikus Vegyületei
A kén számos fontos anorganikus vegyületet alkot, melyek közül néhány létfontosságú az ipar és a biológia számára.
Szulfidok (S$^{2- }$)

A szulfidok olyan vegyületek, amelyekben a kén -2 oxidációs állapotban van. Fémekkel alkotott vegyületei gyakran ionos rácsos szerkezetűek. Számos fém-szulfid a természetben ásványként fordul elő. Például a vas-szulfid (pirit, FeS$_2$) egy gyakori ásvány. A hidrogén-szulfid (H$_2$S) egy színtelen, mérgező gáz, amely jellegzetes záptojásszagú. Laboratóriumban fém-szulfidok savval való reakciójával állítható elő:
\\text\{FeS\} \+ 2\\text\{HCl\} \\rightarrow \\text\{FeCl\}\_2 \+ \\text\{H\}\_2\\text\{S\}
A szulfidok felhasználása sokrétű, a fémércek kinyerésétől a speciális anyagok előállításáig terjed.
Fontosabb Szulfidok
- Nátrium-szulfid (Na$_2$S): A papírgyártásban és a bőrcserzésben használják.
- Cink-szulfid (ZnS): Foszforokban és félvezetőként alkalmazzák.
- Kadmium-szulfid (CdS): Sárga pigmentként és fotocella-gyártásban használatos.
Kén-oxidok
A kén oxigénnel két fő oxidot képez: a kén-dioxidot (SO$_2$) és a kén-trioxidot (SO$_3$).
Kén-dioxid (SO$_2$)
A kén-dioxid színtelen, szúrós szagú gáz. Vulkanikus tevékenység során és fosszilis tüzelőanyagok égetésekor keletkezik. Ipari méretekben kén égetésével állítják elő:
\\text\{S\}\(s\) \+ \\text\{O\}\_2\(g\) \\rightarrow \\text\{SO\}\_2\(g\)
A kén-dioxidot fehérítésre (például gyapjú és selyem), tartósítószerként (borászatban), valamint a kénsavgyártás egyik kiindulási anyagaként használják. A légkörbe kerülve savas esőt okozhat.
Kén-trioxid (SO$_3$)
A kén-trioxid a kénsavgyártás kulcsfontosságú intermedierje. A kén-dioxid katalitikus oxidációjával állítják elő, például vanádium(V)-oxid katalizátor jelenlétében:
2\\text\{SO\}\_2\(g\) \+ \\text\{O\}\_2\(g\) \\rightleftharpoons 2\\text\{SO\}\_3\(g\)
A kén-trioxid erősen higroszkópos, levegőn ködöt képezve elnyeli a vizet, kénsavat alkotva.
Oxosavak és azok sói
A kén számos oxosavat képez, melyek közül a legismertebb a kénsav (H$_2$SO$_4$).
Kénsav (H$_2$SO$_4$)
A kénsav egy színtelen, viszkózus, erősen korrozív folyadék. Az egyik legfontosabb ipari vegyi anyag, amelyet széles körben használnak műtrágyák, műanyagok, festékek, gyógyszerek és sok más termék előállításához. Előállítása több lépésben történik, melynek központi reakciója a kén-trioxid vízzel való reakciója:
\\text\{SO\}\_3\(g\) \+ \\text\{H\}\_2\\text\{O\}\(l\) \\rightarrow \\text\{H\}\_2\\text\{SO\}\_4\(aq\)
A kénsav erős sav, dehidratáló és oxidáló hatású is.
Szulfátok (SO$_4^{2- }$)
A szulfátok a kénsav sói. Számos szulfát a természetben ásványként fordul elő, például a gipsz (CaSO$_4 \cdot 2H_2O$) és a barit (BaSO$_4$). A szulfátokat a műtrágyagyártásban, az építőiparban és a laboratóriumi analitikában használják.
Tioszulfátok (S$_2$O$_3^{2- }$)
A tioszulfátok olyan vegyületek, amelyekben egy kénatomot egy oxigénatom helyettesít a szulfátionban. A legismertebb tioszulfát a nátrium-tioszulfát (Na$_2$S$_2$O$_3$), amelyet a fényképészetben fixálóként és a titrimetriás analízisben használnak.
Szulfitok (SO$_3^{2- }$) és biszulfitok (HSO$_3^-$)
A szulfitok a kénessav (H$_2$SO$_3$) sói, míg a biszulfitok a hidrogénszulfit-iont tartalmazzák. A szulfitokat és biszulfitokat élelmiszer-tartósítószerként és a papírgyártásban használják.
Halogének vegyületei a kénnel
A kén halogénekkel is számos vegyületet képez.
Kén-halogenidek
A legismertebbek közé tartozik a kén-hexafluorid (SF$_6$), amely egy inert, nem mérgező gáz, amelyet elektromos szigetelőként használnak nagyfeszültségű berendezésekben. További példák a kén-diklorid (SCl$_2$) és a tionil-klorid (SOCl$_2$), amelyeket szerves szintézisekben reagensként alkalmaznak.
A Kén Fontosabb Szerves Vegyületei
A kén a szerves kémiában is kulcsszerepet játszik, számos fontos funkcionális csoportot alkotva.
Tiolok (R-SH)
A tiolok (más néven merkaptánok) olyan szerves vegyületek, amelyekben egy hidrogénatomot egy tiol (-SH) csoport helyettesít. Jellemzőjük a gyakran kellemetlen, erős szaguk. A metántiol (CH$_3$SH) a földgázhoz adott szagosító anyag egy komponense. A tiolok fontos szerepet játszanak biológiai folyamatokban is.
Szulfidok (R-S-R’)
A szerves szulfidok (tioéterek) olyan vegyületek, amelyekben egy kénatom két szénatomhoz kapcsolódik. Kevésbé reaktívak, mint a tiolok, de fontos szerepet játszanak bizonyos biológiai molekulákban.
Diszulfidok (R-S-S-R’)
A diszulfidok olyan vegyületek, amelyek egy kén-kén kötést tartalmaznak. A diszulfid-hidak fontosak a fehérjék térszerkezetének kialakításában és stabilizálásában.
Szulfonsavak (R-SO$_3$H)
A szulfonsavak olyan szerves savak, amelyekben egy szulfonil (-SO$_2$OH) csoport található. Erős savak, és számos detergens és festék előállításához használják őket. A legismertebb aromás szulfonsav a benzolszulfonsav.
A Kén Vegyületeinek Előfordulása a Természetben
A kén és vegyületei széles körben elterjedtek a természetben. Elemi kén vulkanikus területeken található meg. Számos fém-szulfid ásványként fordul elő (pl. pirit, galenit, szfalerit). A szulfátok is gyakoriak, például a gipsz és a barit. A tengervíz jelentős mennyiségű szulfátiont tartalmaz. A kén a fehérjék és más biológiailag fontos molekulák nélkülözhetetlen alkotóeleme is.
A Kén Vegyületeinek Ipari Előállítása
A kénsav a legnagyobb mennyiségben előállított kénvegyület. Előállítása általában a kontakteljárással történik, amelynek lépései:
- Kén égetése kén-dioxid előállítására.
- Kén-dioxid katalitikus oxidációja kén-trioxiddá.
- Kén-trioxid abszorpciója tömény kénsavban oleum (füstölgő kénsav) képzésével.
- Az oleum hígítása a kívánt koncentrációjú kénsav előállításához.

Más kénvegyületeket, például a szulfidokat és a szulfitokat, a megfelelő elemek vagy vegyületek reakciójával állítják elő.
A Kén Vegyületeinek Sokrétű Felhasználása
A kénvegyületek felhasználása rendkívül széleskörű:
- Műtrágyák: Szulfátok (pl. ammónium-szulfát) fontos tápanyagforrások a növények számára.
- Ipari kemikáliák: Kénsav, nátrium-szulfid, kén-dioxid számos ipari folyamatban nélkülözhetetlen.
- Gyógyszeripar: Számos gyógyszer tartalmaz ként.
- Gumi vulkanizálás: A kén elengedhetetlen a gumi rugalmasságának biztosításához.
- Tisztítószerek: Szulfonátok felületaktív anyagként működnek.
- Élelmiszeripar: Szulfitokat tartósítószerként használnak.

A Kén Vegyületeinek Környezeti Hatásai
Bár a kénvegyületek számos hasznos alkalmazással rendelkeznek, környezeti hatásaikat is figyelembe kell venni. A kén-dioxid és a nitrogén-oxidok a savas eső fő okozói, ami károsítja az erdőket és a vizeket. A hidrogén-szulfid mérgező gáz. A kibocsátásuk csökkentése érdekében szigorú környezetvédelmi előírások vannak érvényben.
A Savas Eső Kémiája
A fosszilis tüzelőanyagok égetése során a levegőbe kerülő kén-dioxid a légkörben vízzel és oxigénnel reagálva kénsavat képez:
2\\text\{SO\}\_2\(g\) \+ \\text\{O\}\_2\(g\) \+ 2\\text\{H\}\_2\\text\{O\}\(l\) \\rightarrow 2\\text\{H\}\_2\\text\{SO\}\_4\(aq\)
Ez a kénsav a csapadékkal a földre hullva savas esőt okoz.
Összefoglalás
A kén vegyületei a kémia és az ipar számos területén alapvető fontosságúak. Anorganikus és szerves kénvegyületek széles skálája létezik, mindegyik egyedi tulajdonságokkal és felhasználási területekkel. A kénsav ipari jelentősége kiemelkedő, de a szulfidok, oxidok és más kénvegyületek is nélkülözhetetlenek a modern társadalom számára. Ugyanakkor a kénvegyületek környezeti hatásainak kezelése kulcsfontosságú a fenntartható fejlődés szempontjából.
Részletesebben a Szulfátokról
A szulfátok a kénsav sói vagy észterei, amelyek a szulfát-aniont (SO$_4^{2- }$) tartalmazzák. Számos fém-szulfát létezik, amelyek vízben jól oldódnak, kivéve néhányat, mint például a bárium-szulfát (BaSO$_4$), amely oldhatatlan és a laboratóriumi analitikában a báriumionok kimutatására használják. A kalcium-szulfátnak (CaSO$_4$) több hidratált formája ismert, beleértve a gipszet (CaSO$_4 \cdot 2H_2O$) és a hemihidrátot (CaSO$_4 \cdot 0.5H_2O$), amelyet stukkók és gipszkartonok készítéséhez használnak. A magnézium-szulfát (MgSO$_4 \cdot 7H_2O$), más néven keserűsó, gyógyászati célokra és a mezőgazdaságban is
Ken Tulajdonsagai
A Kén Rendkívüli Tulajdonságai: Átfogó Útmutató
A kén egy rendkívül sokoldalú és elterjedt kémiai elem, amely számos területen játszik kulcsszerepet a természettől az iparon át a biológiáig. Ebben a részletes útmutatóban mélyrehatóan feltárjuk a kén egyedülálló tulajdonságait, megvizsgáljuk annak különböző megjelenési formáit, kiterjedt felhasználási lehetőségeit és a vele kapcsolatos érdekességeket.
A Kén Alapvető Kémiai Tulajdonságai
A kén a periódusos rendszer hatodik főcsoportjának (más néven kalkogének) tagja, az oxigén, a szelén, a tellúr és a polónium mellett. Atomszáma 16, vegyjele S. Standard körülmények között a kén sárga, szilárd, nemfémes elem. Kémiailag reaktív, és számos más elemmel képes vegyületeket alkotni. Elektronszerkezete \[Ne] 3s² 3p⁴, ami magyarázza kétértékűségét a legtöbb vegyületében, bár más oxidációs állapotok is léteznek (-2-től +6-ig).
Allotrópia: A Kén Számos Arca
A kén figyelemre méltó tulajdonsága az allotrópia, ami azt jelenti, hogy egy elem többféle szerkezetben is létezhet. A kénnek számos allotróp módosulata ismert, melyek fizikai és kémiai tulajdonságaikban is eltérhetnek. A legismertebb allotrópok a rombos kén (α-kén) és a monoklin kén (β-kén).
Rombos Kén (α-kén)
A rombos kén a kén stabil formája szobahőmérsékleten. Molekulái nyolcatomos gyűrűkből (S<0xE2><0x82><0x88>) állnak, melyek cikcakkos láncot alkotnak. Ezek a gyűrűk laza kristályrácsot képeznek, ami a rombos kén sárga, szilárd megjelenését eredményezi. Sűrűsége körülbelül 2,07 g/cm³, olvadáspontja pedig 115,21 °C.
Monoklin Kén (β-kén)
A monoklin kén 95,4 °C fölött stabil. Szintén S<0xE2><0x82><0x88> gyűrűkből épül fel, de kristályrácsa eltér a rombos kénétől, ami tűszerű kristályokat eredményez. Sűrűsége valamivel kisebb, körülbelül 1,96 g/cm³. 95,4 °C alatt a monoklin kén lassan rombos kénné alakul át.
Amorf Kén (Plasztikus Kén)
Ha olvadt ként hirtelen lehűtünk, egy rugalmas, gumiszerű anyag keletkezik, amelyet amorf kénnek vagy plasztikus kénnek nevezünk. Ebben a formában a kénatomok hosszú, spirális láncokat alkotnak. Az amorf kén nem stabil, idővel visszakristályosodik rombos kénné.
A Kén Fizikai Tulajdonságai
A kén fizikai tulajdonságai nagymértékben függenek allotróp módosulatától. Általánosságban elmondható, hogy a kén szilárd halmazállapotú, sárga színű (bár az amorf kén lehet sötétebb), szagtalan (tiszta formában), és rossz elektromos és hővezető. Olvadáspontja és forráspontja viszonylag alacsony a legtöbb fémhez képest. A kén sűrűsége a különböző allotrópokban eltérő.
- Olvadáspont: 115,21 °C (rombos), 119,6 °C (monoklin)
- Forráspont: 444,6 °C
- Sűrűség: 2,07 g/cm³ (rombos), 1,96 g/cm³ (monoklin)
A Kén Kémiai Reakciói
A kén közepesen reaktív elem. Számos fémmel és nemfémmel reagál hevítés hatására. Leggyakoribb oxidációs állapota a -2, 0, +2, +4 és +6. Erős oxidálószerekkel, például oxigénnel is reakcióba lép, kén-dioxidot (SO₂) képezve.
Reakciók Fémekkel
A kén sok fémmel hevítés hatására szulfidokat képez. Például a vassal reagálva vas(II)-szulfidot (FeS) hoz létre:
$$\text{Fe} + \text{S} \rightarrow \text{FeS}$$
Hasonlóképpen reagál a rézzel is, réz(I)-szulfidot (Cu₂S) képezve:
$$2\text{Cu} + \text{S} \rightarrow \text{Cu}_2\text{S}$$
Reakciók Nemfémekkel
A kén nemfémekkel is reagál. Oxigénnel égve kén-dioxid keletkezik:
$$\text{S} + \text{O}_2 \rightarrow \text{SO}_2$$
Magasabb hőmérsékleten kén-trioxid (SO₃) is képződhet katalizátor jelenlétében.
A kén halogénekkel is reagál, például klórral, többféle kloridot képezve, mint például a dikén-diklorid (S₂Cl₂) és a kén-diklorid (SCl₂).
Reakciók Savakkal és Lúgokkal
A kén nem reagál híg savakkal. Forró, koncentrált salétromsav oxidálja kénsavvá (H₂SO₄):
$$\text{S} + 6\text{HNO}_3 \rightarrow \text{H}_2\text{SO}_4 + 6\text{NO}_2 + 2\text{H}_2\text{O}$$
Lúgokkal hevítve a kén diszproporcionálódik, szulfidot (S²⁻) és tioszulfátot (S₂O₃²⁻) képezve.
A Kén Előfordulása a Természetben
A kén a Földön a tizedik leggyakoribb elem tömeg szerint. Előfordul elemi formában, különösen vulkanikus területeken és üledékes kőzetekben. Emellett számos ásványban is megtalálható szulfidok (például pirit: FeS₂, galenit: PbS, szfalerit: ZnS) és szulfátok (például gipsz: CaSO₄·2H₂O, barit: BaSO₄) formájában.
Vulkanikus Kén
Aktív vulkánok közelében gyakran találhatók kénlerakódások, melyek a vulkáni gázokból (főként kén-dioxid és hidrogén-szulfid) keletkeznek. Ezek a látványos, sárga színű lerakódások a kén elemi formájának egyik legszembetűnőbb megjelenési formái.
Üledékes Kőzetek
A kén üledékes kőzetekben is előfordulhat, gyakran gipsz és anhidrit (CaSO₄) társaságában. Ezek a lerakódások ősi tengerek vagy lagúnák párolgása során jöttek létre.
Szulfid és Szulfát Ásványok
Számos fontos ércásvány tartalmaz ként szulfid formájában. Ezek közé tartozik a vas-szulfid (pirit), a réz-szulfid (chalkopirit), az ólom-szulfid (galenit) és a cink-szulfid (szfalerit). A szulfát ásványok, mint a gipsz és a barit, szintén jelentős kénforrások.
A Kén a Kozmoszban
A kén nemcsak a Földön, hanem a kozmoszban is megtalálható. Kimutatták meteoritokban, és a vulkanikusan aktív égitesteken, mint például a Jupiter Io holdján, ahol a vulkáni tevékenység jelentős mennyiségű ként lövell ki.
A Kén Ipari Felhasználása
A kénnek rendkívül széleskörű ipari felhasználása van. A legnagyobb mennyiségben kénsavat (H₂SO₄) gyártanak belőle, amely az egyik legfontosabb ipari vegyület.
Kénsavgyártás

A kénsav a vegyipar egyik alappillére. Számos ipari folyamatban nélkülözhetetlen, beleértve a műtrágyák gyártását, a kőolaj-finomítást, a fémek pácolását, a festékek és pigmentek előállítását, valamint a műszálak gyártását. A kénsavgyártás fő lépései közé tartozik a kén égetése kén-dioxid előállítására, a kén-dioxid katalitikus oxidációja kén-trioxiddá, majd a kén-trioxid abszorpciója koncentrált kénsavban oleum (füstölgő kénsav) formájában, amit vízzel hígítanak a kívánt koncentráció eléréséhez.
Műtrágyák
A kén fontos tápanyag a növények számára. A kéntartalmú műtrágyák, mint például az ammónium-szulfát ((NH₄)₂SO₄) és a szuperfoszfát, elengedhetetlenek a mezőgazdaságban a megfelelő terméshozam biztosításához.
Gumi Vulkanizálás
A vulkanizálás egy olyan eljárás, amelynek során a nyersgumihoz ként adnak, majd hevítik. Ez a folyamat térhálós szerkezetet hoz létre a polimerláncok között, ami jelentősen javítja a gumi szilárdságát, rugalmasságát és tartósságát. A vulkanizált gumit széles körben használják abroncsok, tömítések és egyéb gumitermékek gyártásához.
Egyéb Ipari Felhasználások
A ként számos más ipari területen is alkalmazzák:
- Papírgyártás (a cellulóz fehérítéséhez használt vegyületekben)
- Dohányipar (bizonyos rovarirtó szerekben)
- Gyógyszeripar (bizonyos gyógyszerekben)
- Pirotechnika (a lőpor egyik összetevője)
- Mosószerek és tisztítószerek

A Kén Biológiai Szerepe
A kén nemcsak az iparban fontos, hanem az élő szervezetek számára is nélkülözhetetlen elem. Számos fontos biomolekula alkotórésze.
Aminosavak és Proteinek

Két esszenciális aminosav, a cisztein és a metionin, tartalmaz ként. Ezek az aminosavak alapvető építőkövei a fehérjéknek, és kulcsszerepet játszanak a fehérjék térszerkezetének kialakításában (diszulfid hidak a cisztein molekulák között) és biológiai aktivitásában.
Vitaminok
Bizonyos vitaminok, például a biotin (B7-vitamin) és a tiamin (B1-vitamin), szintén tartalmaznak ként, és fontos szerepet töltenek be a metabolizmusban.
Egyéb Biológiai Molekulák
A kén megtalálható más fontos biológiai molekulákban is, például a glutationban (egy fontos antioxidáns) és bizonyos koenzimekben.
A Kén Ciklusa a Természetben
A kén ciklus egy biogeokémiai ciklus, amely leírja a kén különböző formáinak mozgását a bioszférában, a litoszférában, a hidroszférában és az atmoszférában. A ciklus fontos lépései közé tartozik a kén felszabadulása a vulkáni tevékenység és a kőzetek mállása révén, a növények általi felvétel szulfát formájában, a szerves kénvegyületek képződése az élőlényekben, a lebontás során felszabaduló kén, valamint a kénvegyületek átalakulása a talajban és a légkörben mikroorganizmusok közreműködésével.
A Kénnel Kapcsolatos Érdekességek
- A ként már az ókorban is ismerték és használták, főként gyógyászati célokra és füstölőként.
- A “kénkő” elnevezés a könnyen éghető, sárga színű elemi kénre utal.
- A kén jellegzetes szaga (amely valójában a kénvegyületeknek, például a hidrogén-szulfidnak köszönhető) jól ismert.
- A kén fontos szerepet játszik a savas eső kialakulásában, mivel a légkörbe kerülő kén-dioxid kénsavvá alakulhat.
Összefoglalás
A kén egy alapvető kémiai elem, amely számos figyelemre méltó tulajdonsággal rendelkezik. Allotrópiája, reaktivitása és széleskörű előfordulása a természetben és az iparban egyaránt kiemelkedővé teszi. A kén nélkülözhetetlen a kénsavgyártáshoz, a műtrágyákhoz, a gumi vulkanizálásához, és létfontosságú szerepet játszik az élő szervezetek biokémiájában. Reméljük, hogy ez az átfogó útmutató részletesen bemutatta a kén lenyűgöző világát.
Ken Elfordulasa
A Kén Előfordulása: Átfogó Tanulmány a Kén Természetes és Ipari Forrásairól
A kén egy nemfémes kémiai elem, amely a periódusos rendszer 16. csoportjában (a kalkogének között) található, S vegyjellel és 16-os rendszámmal. Jellegzetes sárga színű, szilárd halmazállapotú anyag szobahőmérsékleten. A kén az egyik legősibb ismert elem, már az ókorban is használták, főként gyógyászati és füstölési célokra. A modern korban a kén és vegyületei nélkülözhetetlenek számos ipari folyamatban, a mezőgazdaságban és a környezetvédelemben. Jelen cikkünk átfogó képet nyújt a kén természetes és ipari előfordulásáról, kinyerési módszereiről és sokrétű felhasználásáról.
A Kén Természetes Előfordulása
A kén a Földön széles körben elterjedt elem, mind elemi formában, mind különböző vegyületekben megtalálható. A természetben a kén leggyakrabban vulkanikus tevékenységhez kapcsolódik, de jelentős mennyiségben fordul elő bizonyos ásványokban és a bioszférában is.
Vulkáni Eredetű Kén
A vulkáni területek a tiszta, elemi kén egyik leglátványosabb forrásai. A vulkáni gázok, különösen a kén-dioxid (\\text\{SO\}\_2) és a hidrogén-szulfid (\\text\{H\}\_2\\text\{S\}), a felszínre jutva lehűlnek, és kémiai reakciók révén elemi kén válik ki. Ez a folyamat gyakran élénksárga lerakódásokat eredményez a vulkáni kráterek és fumarolák környékén. Történelmileg a vulkáni kén fontos forrás volt, bár kitermelése gyakran veszélyes munkával járt. Napjainkban is vannak olyan helyek, ahol kisebb mértékben bányásznak vulkáni kent, de a modern ipar számára ez a forrás már kevésbé jelentős.
Ásványi Eredetű Kén
A kén számos ásványban megtalálható, leggyakrabban szulfidok és szulfátok formájában. A szulfidásványok olyan vegyületek, amelyekben a kén fémekkel alkot vegyületet. Néhány fontosabb szulfidásvány közé tartozik a pirit (\\text\{FeS\}\_2), más néven “bolondok aranya”, a szfalerit (\\text\{ZnS\}), a galenit (\\text\{PbS\}) és a kalkopirit (\\text\{CuFeS\}\_2). Ezek az ásványok nemcsak a kén forrásai lehetnek, hanem fontos fémércek is. A szulfátásványok olyan vegyületek, amelyekben a szulfátion (\\text\{SO\}\_4^\{2\-\}) található. Jelentős szulfátásvány a gipsz (\\text\{CaSO\}\_4 \\cdot 2\\text\{H\}\_2\\text\{O\}) és az anhidrit (\\text\{CaSO\}\_4). Ezek az ásványok a kén mellett kalciumot is tartalmaznak, és széles körben használják az építőiparban és más területeken.
Kén a Bioszférában
A kén az élet szempontjából is nélkülözhetetlen elem. Számos aminosav (például a cisztein és a metionin) tartalmaz kent, amelyek a fehérjék felépítésében játszanak kulcsszerepet. A növények a talajból szulfátionok formájában veszik fel a kent, amelyet aztán szerves vegyületeikké alakítanak át. Az állatok és az emberek a táplálékkal jutnak hozzá a szükséges kénhez. A kén emellett fontos szerepet játszik a mikrobiális anyagcserében is. Bizonyos baktériumok képesek a kénvegyületek átalakítására, például a hidrogén-szulfidot oxidálják elemi kénné vagy szulfáttá, vagy éppen fordítva, szulfátokat redukálnak szulfidokká. Ezek a biogeokémiai ciklusok biztosítják a kén folyamatos áramlását a környezetben.
A Kén Ipari Kinyerése
A modern ipar számára a kén kinyerésének két fő módja létezik: az elemi kén bányászata és a kénvegyületeket tartalmazó melléktermékekből való kinyerés.

A Frasch-eljárás
A mélyen fekvő elemi kén lelőhelyek kitermelésére kifejlesztett Frasch-eljárás forradalmasította a kén bányászatát. Herman Frasch amerikai vegyész nevéhez fűződik ez a módszer, amelyet a 19. század végén szabadalmaztatott. Az eljárás lényege, hogy három koncentrikus csövön keresztül forró vizet (kb. 165^\\circ C), túlhevített vizet és sűrített levegőt juttatnak a föld alá a kénréteghez. A forró víz megolvasztja a kent (olvadáspontja kb. 115^\\circ C), a sűrített levegő pedig hab formájában a felszínre nyomja az olvadt kent a belső csövön keresztül. A felszínen a folyékony kén tartályokba kerül, ahol lehűl és megszilárdul. A Frasch-eljárás lehetővé tette a korábban nehezen hozzáférhető kénkészletek gazdaságos kitermelését, és jelentősen növelte a rendelkezésre álló kén mennyiségét.

Kén Kinyerése Melléktermékekből
Napjainkban a kitermelt kén jelentős része kőolaj- és földgázfinomítás, valamint érckohászat során keletkező kénvegyületekből származik. A kőolaj és a földgáz gyakran tartalmaz kénvegyületeket, például hidrogén-szulfidot (\\text\{H\}\_2\\text\{S\}). A finomítási folyamatok során ezeket a vegyületeket eltávolítják, hogy csökkentsék a károsanyag-kibocsátást és megakadályozzák a korróziót. A hidrogén-szulfidot általában a Claus-eljárással alakítják át elemi kénné. Ebben az eljárásban a hidrogén-szulfid egy részét levegővel elégetik kén-dioxiddá (\\text\{SO\}\_2), majd a megmaradt hidrogén-szulfidot a képződött kén-dioxiddal katalizátor jelenlétében reagáltatják, melynek eredményeként elemi kén és víz keletkezik:
2 \\text\{H\}\_2\\text\{S\} \+ \\text\{SO\}\_2 \\rightarrow 3 \\text\{S\} \+ 2 \\text\{H\}\_2\\text\{O\}
Az érckohászat során a szulfidásványok pörkölésekor szintén kén-dioxid keletkezik, amelyet kénsavgyártásra lehet felhasználni, így közvetve ez is hozzájárul a kén hasznosításához. A melléktermékekből való kénkinyerés egyre fontosabbá válik a környezetvédelmi szempontok előtérbe kerülésével, hiszen lehetővé teszi a káros kénvegyületek ártalmatlanítását és értékes nyersanyagként való felhasználását.
A Kén Felhasználása
A kén és vegyületei rendkívül sokoldalúan felhasználhatók a különböző iparágakban. A legnagyobb mennyiségben kénsavat (\\text\{H\}\_2\\text\{SO\}\_4) gyártanak belőle, amely az egyik legfontosabb ipari vegyi anyag. Emellett a kent felhasználják a mezőgazdaságban, a gumiiparban, a gyógyszeriparban és számos más területen.
Kénsavgyártás
A kén legnagyobb felhasználási területe a kénsavgyártás. A kénsavat a kontakteljárással állítják elő, amelynek fő lépései a következők:
- Elemi kén elégetése kén-dioxiddá: \\text\{S\}\(s\) \+ \\text\{O\}\_2\(g\) \\rightarrow \\text\{SO\}\_2\(g\)
- A kén-dioxid katalitikus oxidációja kén-trioxiddá: 2 \\text\{SO\}\_2\(g\) \+ \\text\{O\}\_2\(g\) \\rightleftharpoons 2 \\text\{SO\}\_3\(g\) (Vanádium(V)-oxid (\\text\{V\}\_2\\text\{O\}\_5) katalizátor jelenlétében)
- A kén-trioxid abszorpciója tömény kénsavban oleum (\\text\{H\}\_2\\text\{S\}\_2\\text\{O\}\_7) képződésével, majd víz hozzáadásával kénsav nyerése: \\text\{SO\}\_3\(g\) \+ \\text\{H\}\_2\\text\{SO\}\_4\(l\) \\rightarrow \\text\{H\}\_2\\text\{S\}\_2\\text\{O\}\_7\(l\) \\text\{H\}\_2\\text\{S\}\_2\\text\{O\}\_7\(l\) \+ \\text\{H\}\_2\\text\{O\}\(l\) \\rightarrow 2 \\text\{H\}\_2\\text\{SO\}\_4\(l\)
A kénsav rendkívül sokoldalú vegyi anyag, amelyet széles körben használnak a műtrágyagyártásban (például szuperfoszfát előállításához), a fémfeldolgozásban (acélpácolás), a kőolaj-finomításban, a festék- és pigmentgyártásban, a műszálgyártásban és számos más ipari folyamatban.
Felhasználás a Mezőgazdaságban

A kén fontos tápanyag a növények számára. Szükséges a fehérjék, enzimek és vitaminok szintéziséhez. A talajban a kén gyakran szulfát formájában található meg, amelyet a növények fel tudnak venni. Bizonyos területeken a talaj kénben szegény lehet, ilyenkor kén tartalmú műtrágyák alkalmazása válhat szükségessé. Ilyen műtrágyák lehetnek például az ammónium-szulfát ((\\text\{NH\}\_4\)\_2\\text\{SO\}\_4) és a gipsz (\\text\{CaSO\}\_4 \\cdot 2\\text\{H\}\_2\\text\{O\}). A kent emellett fungicidek és rovarirtók összetevőjeként is használják a mezőgazdaságban.
Felhasználás a Gumiiparban
A kent széles körben alkalmazzák a gumi vulkanizálásához. Ez a folyamat, amelyet Charles Goodyear fedezett fel a 19. században, javítja a gumi rugalmasságát, szilárdságát és tartósságát. A vulkanizálás során a kénatomok keresztkötéseket hoznak létre a polimerláncok között, ami egy térhálós szerkezetet eredményez. A vulkanizált gumi sokkal ellenállóbb a hővel és a kopással szemben, ezért nélkülözhetetlen a gumiabroncsok, tömítések és más gumitermékek gyártásához.
Egyéb Felhasználási Területek
A kent számos más területen is alkalmazzák. A gyógyszeriparban bizonyos bőrbetegségek kezelésére használt készítmények tartalmazhatnak kent. A festék- és pigmentiparban egyes pigmentek előállításához van szükség kénre. A papírgyártásban a cellulóz feltárásához használt eljárások során is alkalmaznak kénvegyületeket (szulfitos eljárás). A pirotechnikában a kent a lőpor egyik összetevője, és más pirotechnikai elegyekben is megtalálható. Emellett a kent felhasználják bizonyos műanyagok és ragasztók gyártásához is.
A Kén Környezeti Hatásai
Bár a kén önmagában egy természetes elem, az emberi tevékenység következtében a kénvegyületek kibocsátása jelentős környezeti problémákat okozhat. A fosszilis tüzelőanyagok (szén, kőolaj) égetése során kén-dioxid (\\text\{SO\}\_2) kerül a légkörbe, amely savas eső formájában károsíthatja az ökoszisztémákat, a talajt és az épületeket. A savas eső hatására a tavak és folyók pH-értéke csökkenhet, ami káros a vízi élőlényekre. Emellett a talaj savasodása a növények számára fontos tápanyagok kimosódásához vezethet. A kén-dioxid a levegőben szálló porral reagálva szulfát aeroszolokat képezhet, amelyek befolyásolják a légköri sugárzást és hozzájárulhatnak a légzőszervi megbetegedések kialakulásához. Éppen ezért kiemelten fontos a kénvegyületek kibocsátásának csökkentése a különböző ipari folyamatokban és az energiatermelés során.

A Környezetvédelmi Szerep
Érdekes módon a kénnek a környezetvédelemben is lehet pozitív szerepe. Bizonyos kénvegyületeket, például a kalcium-poliszulfidot, a talajjavításra és a növényvédelmre használnak. A kén emellett fontos szerepet játszik bizonyos környezetvédelmi technológiákban, például a füstgázok kéntelenítésében, ahol a kén-dioxidot különböző módszerekkel távolítják el a kibocsátott gázokból, megakadályozva ezzel a savas eső kialakulását. A kéntelenítési eljárások során gyakran gipsz keletkezik melléktermékként, amelyet az építőiparban lehet hasznosítani. Így a kén nemcsak potenciális szennyező anyag lehet, hanem a környezeti problémák megoldásában is segíthet.
Összefoglalás

A kén egy sokoldalú és nélkülözhetetlen elem, amely a természetben elemi formában és számos vegyületben előfordul. Ipari kinyerése főként a Frasch-eljárással és a melléktermékekből való hasznosítással történik. Felhasználása rendkívül széleskörű, a kénsavgyártástól a mezőgazdaságon és a gumiiparon át számos más területig terjed. Bár a kénvegyületek kibocsátása környezeti problémákat okozhat, a kénnek a környezetvédelemben is fontos szerepe lehet. A k
Kavegep Vizktelenitese Citromsavval
A Kávégép Vízkőtelenítésének Művészete Citromsavval: Átfogó Útmutató

A frissen főzött kávé illata és íze sokunk számára a nap tökéletes kezdete. Ahhoz azonban, hogy ez az élmény hosszú távon megmaradjon, elengedhetetlen a kávégép rendszeres karbantartása, különös tekintettel a vízkő eltávolítására. A vízkő nem csupán a készülék élettartamát csökkentheti, hanem a kávé ízét is jelentősen befolyásolhatja. Ebben a részletes útmutatóban bemutatjuk, hogyan végezheted el a kávégép vízkőtelenítését hatékonyan és biztonságosan citromsavval, lépésről lépésre.
Miért Fontos a Kávégép Rendszeres Vízkőtelenítése?
A vízben oldott ásványi anyagok, különösen a kalcium és a magnézium, hő hatására kicsapódnak és lerakódnak a kávégép belső felületein. Ez a folyamat a vízkőképződés. A felhalmozódó vízkő számos problémához vezethet:
- Csökkent hőátadás: A vízkő szigetelőként viselkedik, ami azt jelenti, hogy a fűtőelemnek keményebben kell dolgoznia a víz felmelegítéséhez, növelve az energiafogyasztást és meghosszabbítva a felfűtési időt.
- Eltömődött csatornák: A vízkő lerakódhat a csövekben és a fúvókákban, ami a víz áramlásának akadályozásához, gyengébb kávéhoz és akár a készülék meghibásodásához is vezethet.
- Megváltozott kávéíz: A vízkő befolyásolhatja a víz kémiai összetételét, ami érezhetően megváltoztathatja a kávé ízét, gyakran keserűbbé téve azt.
- Rövidebb élettartam: A folyamatosan vízkővel terhelt alkatrészek hamarabb elhasználódhatnak, csökkentve a kávégép élettartamát.
A rendszeres vízkőtelenítés segít megelőzni ezeket a problémákat, biztosítva a kávégép optimális működését és a kávé kiváló ízét.
Miért Érdemes Citromsavat Használni a Vízkőtelenítéshez?
Számos kereskedelmi forgalomban kapható vízkőtelenítő létezik, azonban a citromsav egy természetes, olcsó és hatékony alternatíva. Előnyei közé tartozik:
- Hatékonyság: A citromsav hatékonyan oldja fel a vízkövet.
- Környezetbarát: Biológiailag lebomló, így kíméli a környezetet.
- Költséghatékony: Általában olcsóbb, mint a speciális vízkőtelenítő szerek.
- Könnyen beszerezhető: Szinte minden háztartásban megtalálható, vagy könnyen beszerezhető a boltokban.
- Kíméletes: Megfelelő hígításban általában kíméletesebb a kávégép alkatrészeihez, mint néhány erősebb vegyi anyag.

Fontos azonban megjegyezni, hogy bizonyos esetekben a gyártó kifejezetten nem javasolja a citromsav használatát. Mindig érdemes ellenőrizni a kávégép használati útmutatóját.
A Citromsav Hatásmechanizmusa a Vízkő Eltávolításában
A vízkő főként kalcium-karbonátból (\\text\{CaCO\}\_3) áll. A citromsav (\\text\{C\}\_6\\text\{H\}\_8\\text\{O\}\_7) egy gyenge szerves sav, amely reakcióba lép a kalcium-karbonáttal, és vízoldékony kalcium-citrátot képez, valamint szén-dioxidot és vizet szabadít fel. A reakció kémiai egyenlete a következő:
\\text\{2 C\}\_6\\text\{H\}\_8\\text\{O\}\_7\(aq\) \+ 3 \\text\{CaCO\}\_3\(s\) \\rightarrow \\text\{Ca\}\_3\(\\text\{C\}\_6\\text\{H\}\_5\\text\{O\}\_7\)\_2\(aq\) \+ 3 \\text\{CO\}\_2\(g\) \+ 3 \\text\{H\}\_2\\text\{O\}\(l\)
Ez a kémiai folyamat teszi lehetővé a vízkő hatékony eltávolítását a kávégép belső felületeiről.
Lépésről Lépésre: A Kávégép Vízkőtelenítése Citromsavval
A kávégép vízkőtelenítése citromsavval egy viszonylag egyszerű folyamat, amelyet otthon is könnyedén elvégezhetsz. Kövesd az alábbi lépéseket a hatékony és biztonságos tisztítás érdekében:
1. Szükséges Eszközök és Anyagok Előkészítése
Mielőtt elkezdenéd a vízkőtelenítést, győződj meg róla, hogy minden szükséges eszköz és anyag kéznél van:
- Citromsav: Kristályos formában vagy frissen facsart citromlé. Kristályos citromsav esetén általában 1-2 evőkanálnyi mennyiség elegendő, de ez a kávégép méretétől és a vízkő mértékétől függően változhat. Friss citromlé használatakor körülbelül 100-150 ml-re lehet szükség.
- Víz: A citromsav feloldásához és a kávégép átöblítéséhez.
- Mérőedény vagy pohár: A víz és a citromsav pontos kiméréséhez.
- Tiszta rongy vagy szivacs: A külső felületek tisztításához.
2. A Citromsavas Oldat Elkészítése
Készítsd el a vízkőtelenítő oldatot. Ha kristályos citromsavat használsz, oldd fel körülbelül 1-2 evőkanálnyi port 1 liter meleg vízben. Keverd addig, amíg a citromsav teljesen fel nem oldódik. Ha friss citromlevet használsz, keverj össze körülbelül 100-150 ml citromlevet 1 liter vízzel.
Fontos: Soha ne használj tömény citromsavat, mert az károsíthatja a kávégép alkatrészeit. Mindig hígítsd fel vízzel a megfelelő arányban.
3. A Vízkőtelenítő Oldat Betöltése a Kávégépbe
Öntsd a elkészített citromsavas oldatot a kávégép víztartályába a maximális szintig. Ha a kávégéped rendelkezik vízkőtelenítő programmal, kövesd a gyártó utasításait a program elindításához. Ha nincs ilyen program, a következő lépésekkel folytathatod.
4. A Vízkőtelenítő Ciklus Lefuttatása
Indítsd el a kávéfőzést úgy, mintha kávét készítenél, de ne tegyél őrölt kávét a szűrőbe. Hagyd, hogy a gép lefőzze a citromsavas oldat felét. Ezután kapcsold ki a gépet, és hagyd állni körülbelül 20-30 percig. Ez idő alatt a citromsav kifejti hatását a vízkőre.
A várakozási idő letelte után indítsd újra a kávéfőzést, és hagyd, hogy a maradék citromsavas oldat is átfolyjon a gépen. Egyes kávégépek esetében javasolt több ciklust lefuttatni a teljes tartálynyi oldattal.
5. A Kávégép Átöblítése Tiszta Vízzel
A vízkőtelenítő ciklus befejezése után alaposan öblítsd át a kávégépet tiszta vízzel, hogy eltávolítsd a citromsav maradványait. Ehhez öntsd tele a víztartályt tiszta vízzel, és indíts el legalább két-három teljes ciklust anélkül, hogy kávét tennél bele. Ez biztosítja, hogy a következő kávéd íze tiszta és friss legyen.
Ügyelj arra, hogy a víztartályt minden öblítési ciklus után ürítsd ki és töltsd újra friss vízzel.
6. A Kávégép Külső Tisztítása
Amíg a gép belsejét öblíted, ne felejtsd el megtisztítani a külső felületeket is egy nedves ronggyal vagy szivaccsal. Távolítsd el a kávéfoltokat és egyéb szennyeződéseket.
Gyakori Hibák a Vízkőtelenítés Során és Hogyan Kerülheted El Őket
A kávégép vízkőtelenítése citromsavval általában problémamentes, de néhány gyakori hibát érdemes elkerülni:
- Túl tömény oldat használata: Ez károsíthatja a gép alkatrészeit. Mindig tartsd be a javasolt hígítási arányokat.
- Nem elegendő átöblítés: A citromsav maradványai befolyásolhatják a kávé ízét. Mindig végezz alapos öblítést tiszta vízzel.
- A gyártó utasításainak figyelmen kívül hagyása: Egyes gyártók speciális vízkőtelenítő szereket javasolnak, vagy tiltják a citromsav használatát. Mindig olvasd el a kávégép használati útmutatóját.
- Túl ritka vízkőtelenítés: A vízkő folyamatosan képződik, ezért fontos a rendszeres tisztítás. A vízkeménységtől függően havonta vagy kéthavonta érdemes elvégezni a vízkőtelenítést.

Mikor Szükséges Vízkőteleníteni a Kávégépet?
Több jel is utalhat arra, hogy itt az ideje a kávégép vízkőtelenítésének:
- Lassabb kávéfőzés: Ha a kávé a megszokottnál lassabban folyik le.
- Hangosabb működés: A vízkő lerakódások miatt a gép hangosabban működhet.
- Gyengébb kávé vagy megváltozott íz: A vízkő befolyásolhatja a kávé aromáját és ízét.
- Fehér vagy sárgás lerakódások: Látható vízkő a víztartályban vagy a kifolyónyílások környékén.
- A kávégép figyelmeztető jelzése: Sok modern kávégép rendelkezik beépített vízkőtelenítés emlékeztetővel.

A vízkőtelenítés gyakorisága függ a használt víz keménységétől és a kávéfogyasztás mértékétől. Kemény víz esetén gyakrabban lehet szükség a tisztításra.
Alternatív Vízkőtelenítési Módszerek
Bár a citromsav egy kiváló választás a vízkőtelenítéshez, léteznek más módszerek és anyagok is, amelyeket használhatsz:
- Ecet: Az ecet szintén hatékonyan oldja a vízkövet. Használatához keverj össze egy rész ecetet két rész vízzel, és járasd át a kávégépen. Utána alaposan öblítsd ki tiszta vízzel, hogy az ecet szaga ne maradjon meg.
- Speciális vízkőtelenítő szerek: A kereskedelemben kaphatók kifejezetten kávégépekhez kifejlesztett vízkőtelenítő oldatok és tabletták. Ezek általában a gyártó ajánlásait követve használhatók.

Mindig vedd figyelembe a kávégéped típusát és a gyártó ajánlásait, mielőtt bármilyen vízkőtelenítő módszert alkalmaznál.
Az Ecet Használata: Előnyök és Hátrányok
Az ecet egy másik népszerű házi szer a vízkő eltávolítására. Előnye a széles körű elérhetőség és az alacsony költség. Azonban a savanyú szaga sokak számára kellemetlen lehet, és ha nem öblítjük ki elég alaposan a gépet, az befolyásolhatja a kávé ízét. Javasolt az ecetes oldat után többször átöblíteni a kávégépet tiszta vízzel.
Speciális Vízkőtelenítő Szerek: Mire Érdemes Figyelni?
A speciális vízkőtelenítő szerek gyakran a gyártók saját termékei, amelyeket kifejezetten az adott kávégéptípushoz fejlesztettek ki. Ezek használata általában biztonságos és hatékony, de általában drágábbak, mint a házi alternatívák. Vásárlás előtt érdemes ellenőrizni a termék összetételét és a felhasználói véleményeket.
A Vízkő Megelőzése: Tippek a Hosszú Élettartamért
A vízkőképződés teljesen nem kerülhető el, de néhány egyszerű lépéssel lassíthatjuk a folyamatot:
- Szűrt víz használata: A szűrt víz kevesebb ásványi anyagot tartalmaz, így csökkenti a vízkő lerakódásának esélyét. Használhatsz víztisztító kancsót vagy beépített vízszűrővel rendelkező kávégépet.
- A víztartály rendszeres ürítése: Ne hagyd sokáig állni a vizet a tartályban, különösen, ha az nem szűrt víz.
- Rendszeres tisztítás: A kisebb lerakódásokat könnyebb eltávolítani, ezért érdemes gyakrabban elvégezni egy enyhé

Joule Kilojoule Atvaltas
Joule Kilojoule Átváltás: A Teljes Útmutató
Ebben a részletes útmutatóban mélyrehatóan megvizsgáljuk a joule (J) és a kilojoule (kJ) közötti kapcsolatot. Célunk, hogy minden olvasó számára érthetővé tegyük ezt az alapvető energiaegység-átváltást, legyen szó fizikáról tanuló diákról, mérnökről vagy bárkiről, akinek szüksége van erre az ismeretre. Bemutatjuk a pontos átváltási képleteket, számos gyakorlati példán keresztül illusztráljuk a használatukat, és praktikus tanácsokat adunk a mindennapi alkalmazáshoz.
Mi az a Joule? Az Energia Alapegysége
A joule a Nemzetközi Mértékegységrendszerben (SI) az energia, a munka vagy a hő mennyiségének származtatott egysége. Nevét James Prescott Joule angol fizikusról kapta. Egy joule egyenlő azzal a munkával, amelyet akkor végzünk, ha egy newton erővel egy méteren keresztül mozgatunk egy tárgyat. Alapegységekkel kifejezve: $\text{1 J} = \text{1 kg} \cdot \text{m}^2 \cdot \text{s}^{ -2}$. A joule rendkívül sokoldalú egység, amelyet a fizika számos területén használnak, beleértve a mechanikát, a termodinamikát, az elektromosságot és a mágnesességet.
A Joule gyakorlati jelentősége
A joule nem csupán egy elméleti fogalom; a mindennapi életünkben is gyakran találkozhatunk vele. Például az élelmiszerek energiatartalmát gyakran kilojoule-ban adják meg, de a mögöttük álló alapvető egység a joule. Egy elektromos készülék által felhasznált energia mennyiségét is joule-ban vagy annak többszörösében mérjük. A fizikai kísérletek és a mérnöki tervezés során a joule pontos ismerete elengedhetetlen a számításokhoz és a rendszerek megértéséhez.
Mi az a Kilojoule? A Joule Nagyobb Egysége
A kilojoule (kJ) a joule egy többszöröse, pontosan ezerszerese. A “kilo-” előtag a görög eredetű “khilioi” szóból származik, ami ezret jelent. Tehát: $\text{1 kJ} = 1000 \text{ J}$. A kilojoule-t gyakran használják nagyobb energiamennyiségek kifejezésére, mivel a joule bizonyos esetekben túl kicsi egységnek bizonyulna a praktikus használathoz. Ilyen területek például az élelmiszeripar, a fűtés és a nagyipari energiafelhasználás.
A Kilojoule szerepe a mindennapi életben
Amikor egy élelmiszer csomagolásán látjuk az energiatartalmat, az szinte mindig kilojoule-ban van megadva. Ez sokkal praktikusabb, mint nagyszámú joule-t írni. Például egy átlagos felnőtt napi energiaigénye körülbelül 8000-10000 kJ. A fűtési rendszerek teljesítményét is gyakran kilojoule per órában (kJ/h) adják meg. A kilojoule tehát egy fontos egység a nagyobb léptékű energiafogyasztás és -termelés leírására.
A Joule és Kilojoule közötti alapvető átváltás
Az átváltás a két egység között rendkívül egyszerű. Mivel $\text{1 kJ} = 1000 \text{ J}$, ezért:
- Joule-ból kilojoule-ba váltáshoz a joule értéket el kell osztanunk 1000-rel: $$\text{kJ} = \frac{\text{J}}{1000}$$
- Kilojoule-ból joule-ba váltáshoz a kilojoule értéket meg kell szoroznunk 1000-rel: $$\text{J} = \text{kJ} \times 1000$$
Ez az egyszerű szorzás vagy osztás teszi lehetővé, hogy könnyedén váltsunk a két mértékegység között, attól függően, hogy éppen melyik a legmegfelelőbb a kontextusban.
Példák a Joule-Kilojoule átváltásra
Nézzünk néhány gyakorlati példát az átváltás megértéséhez:

- Ha egy rendszer energiája 5000 joule, akkor ez kilojoule-ban: $$\frac{5000 \text{ J}}{1000} = 5 \text{ kJ}$$
- Ha egy élelmiszer energiatartalma 250 kJ, akkor ez joule-ban: $$250 \text{ kJ} \times 1000 = 250000 \text{ J}$$
- Egy 12000 joule energiájú folyamat kilojoule-ban kifejezve: $$\frac{12000 \text{ J}}{1000} = 12 \text{ kJ}$$
- Ha egy fűtőberendezés 3,6 MJ (megajoule, ahol 1 MJ = 1 000 000 J) energiát termel óránként, ez kilojoule-ban óránként: $$\frac{3600000 \text{ J}}{1000} = 3600 \text{ kJ/h}$$
Ezek a példák jól szemléltetik, hogyan alkalmazhatjuk a fenti egyszerű képleteket a gyakorlatban.
Mikor melyik egységet használjuk?
A választás a joule és a kilojoule között gyakran a kényelemtől és a kontextustól függ. Általánosságban elmondható, hogy kisebb energiamennyiségek esetén a joule a praktikusabb, míg nagyobb mennyiségeknél a kilojoule használata áttekinthetőbbé teszi a számokat.
A Joule használata
A joule gyakran előfordul a fizikai alapelvek leírásakor, például a munkatétel vagy az energia megmaradásának törvénye kapcsán. Kisebb léptékű kísérletek és számítások során, ahol az energiamennyiségek nem túl nagyok, a joule a természetes választás. Például egy kondenzátorban tárolt energia, egy rugóban tárolt potenciális energia vagy egy apró részecske kinetikus energiája gyakran joule-ban kerül kifejezésre.
A Kilojoule használata
A kilojoule elterjedtebb a mindennapi alkalmazásokban és a nagyobb léptékű rendszerek leírásakor. Az élelmiszeriparban szinte kizárólag kilojoule-ban adják meg az energiatartalmat. A fűtés, a légkondicionálás és az ipari folyamatok energiafelhasználását is gyakran kilojoule-ban vagy még nagyobb egységekben (pl. megajoule, gigajoule) szokás megadni. Ez segít elkerülni a nagyon nagy számokat, amelyek nehezen áttekinthetők lennének joule-ban kifejezve.
Részletes áttekintés: A Joule eredete és definíciója
Ahogy korábban említettük, a joule James Prescott Joule munkásságának állít emléket. Joule kísérletei a hő és a mechanikai munka közötti kapcsolatra fókuszáltak, és kulcsszerepet játszottak az energiamegmaradás elvének megértésében. A joule SI-definíciója a következőképpen alakul:
$$\text{1 J} = 1 \frac{\text{kg} \cdot \text{m}^2}{\text{s}^2} = 1 \text{ N} \cdot \text{m} = 1 \text{ W} \cdot \text{s}$$
Ahol:
- N a newton (az erő egysége)
- m a méter (a távolság egysége)
- W a watt (a teljesítmény egysége)
- s a másodperc (az idő egysége)
Ez a definíció rávilágít a joule sokoldalúságára és arra, hogy hogyan kapcsolódik más alapvető fizikai mennyiségekhez.
A Joule kapcsolata más energiaegységekkel
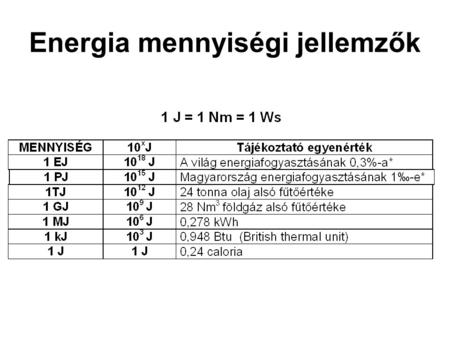
Érdemes megemlíteni, hogy a joule nem az egyetlen energiaegység. Gyakran találkozhatunk más egységekkel is, mint például a kalória (cal), a kilowattóra (kWh) vagy az elektronvolt (eV). Az alábbiakban röviden összefoglaljuk ezek kapcsolatát a joule-lal:
- 1 kalória (cal) ≈ 4,184 joule (J)
- 1 kilokalória (kcal) = 1000 cal ≈ 4184 joule (J)
- 1 kilowattóra (kWh) = 3,6 × 10^6 joule (J)
- 1 elektronvolt (eV) ≈ 1,602 × 10^-19 joule (J)
Bár ezek az egységek különböző területeken elterjedtek, a joule az SI-rendszer alapvető energiaegysége, így minden más energiaegység végső soron kifejezhető joule-ban.
Részletes áttekintés: A Kilojoule használatának előnyei
A kilojoule használatának fő előnye a nagyobb energiamennyiségek kezelésének egyszerűsítése. Ahelyett, hogy nagy számokkal dolgoznánk joule-ban, a kilojoule lehetővé teszi, hogy kisebb, könnyebben kezelhető számokat használjunk. Ez különösen fontos a kereskedelemben, az iparban és a mindennapi kommunikációban.

Kilojoule az élelmiszeriparban
Az élelmiszerek energiatartalmának jelölése szinte mindenhol kilojoule-ban történik. Ez megkönnyíti a fogyasztók számára az egyes termékek energiatartalmának összehasonlítását és a napi energiabevitelük nyomon követését. Egy átlagos táplálkozási címkén az energiaérték kJ-ban és gyakran kcal-ban is meg van adva.
Kilojoule a fűtés- és légkondicionálástechnikában
A fűtőberendezések és légkondicionálók teljesítményét gyakran kilojoule per órában (kJ/h) vagy kilowattban (kW, ahol 1 kW = 3600 kJ/h) adják meg. Ez a mértékegység segít a felhasználóknak megérteni, hogy mennyi energiát képes leadni vagy felvenni az adott berendezés egy óra alatt, ami fontos a megfelelő készülék kiválasztásához és az energiafogyasztás becsléséhez.
Gyakorlati feladatok: Joule és Kilojoule átváltás
Most nézzünk néhány gyakorlati feladatot, hogy még jobban rögzüljön az átváltás:
- Válts át 7500 joule-t kilojoule-ba.
- Válts át 3,2 kilojoule-t joule-ba.
- Egy folyamat 150000 joule energiát igényel. Hány kilojoule ez?
- Egy élelmiszer energiatartalma 920 kJ. Hány joule ez?
A feladatok megoldásai

- $$7500 \text{ J} \div 1000 = 7,5 \text{ kJ}$$
- $$3,2 \text{ kJ} \times 1000 = 3200 \text{ J}$$
- $$150000 \text{ J} \div 1000 = 150 \text{ kJ}$$
- $$920 \text{ kJ} \times 1000 = 920000 \text{ J}$$
Reméljük, ezek a feladatok segítettek jobban megérteni az átváltást a két egység között.
Online Joule-Kilojoule átváltó eszköz
Azonnali átváltáshoz használhatod online átváltó eszközünket:
Kérjük, add meg az átváltandó értéket:
kJ
J
Összefoglalás: A Joule és Kilojoule fontossága
A joule és a kilojoule alapvető energiaegységek, amelyek elengedhetetlenek a fizikai és mérnöki tudományokban, valamint a mindennapi élet számos területén. A kettő közötti egyszerű átváltás lehetővé teszi számunkra, hogy a kontextusnak leginkább megfelelő egységet használjuk az energiamennyiségek kifejezésére. Reméljük, ez a részletes útmutató segített tisztázni a joule és a kilojoule közötti kapcsolatot és azok gyakorlati alkalmazásait.
További információk és források
- SI alapegységek: [Link egy megbízható forráshoz]
- Energia mértékegységei: [Link egy megbízható forráshoz]
Gyakran Ismételt Kérdések (GYIK)
- Hány joule egy kilojoule?
- Egy kilojoule pontosan 1000 joule.
- Mikor érdemes kilojoule-t használni?
- Nagyobb energiamennyiségek kifejezésére, például élelmiszerek energiatartalmának vagy fűtési rendszerek teljesítményének megadásakor.
- Mi a joule SI-definíciója?
- 1 joule = 1 kg ⋅ m²/s².
Köszönjük, hogy elolvastad útmutatónkat!
Alu Lochblech Pulverbeschichtet Preis
Alu Lochblech Porfestett Ár: A Legátfogóbb Leitfaden a Vásárláshoz
Üdvözöljük átfogó útmutatónkban az alu lyukacsos lemez porfestett árával kapcsolatban. Célunk, hogy minden szükséges információt megadjunk Önnek ahhoz, hogy tájékozott döntést hozhasson, legyen szó ipari felhasználásról, építészeti projektről vagy barkácsolásról. Ebben a részletes cikkben feltárjuk az árakat befolyásoló tényezőket, összehasonlítjuk a különböző minőségeket és beszállítókat, valamint gyakorlati tanácsokat adunk a legjobb ár-érték arány eléréséhez.
Miért Válassza az Alu Lochblechet Porfestett Kivitelben? Előnyök és Alkalmazások

Az alu lyukacsos lemez egy rendkívül sokoldalú anyag, amelyet számos iparágban és alkalmazásban használnak. A porfestés pedig tovább növeli ennek az anyagnak az előnyeit. Nézzük meg részletesen, miért érdemes a porfestett alu lyukacsos lemezt választani:
Az Alu Lochblech Előnyei
- Könnyű súly: Az alumínium sűrűsége alacsony, így a belőle készült lemezek könnyűek, ami megkönnyíti a szállítást és a beépítést.
- Korrózióállóság: Az alumínium természetes módon ellenáll a korróziónak, ami hosszú élettartamot biztosít még kültéri alkalmazások esetén is.
- Jó megmunkálhatóság: Az alumínium könnyen vágható, hajlítható és formázható, így sokféle projektben felhasználható.
- Esztétikus megjelenés: A lyukacsos mintázat önmagában is esztétikus, a porfestés pedig tovább növeli a vizuális vonzerőt.
- Szellőzés és fényáteresztés: A lyukak lehetővé teszik a levegő és a fény áramlását, ami bizonyos alkalmazásoknál kulcsfontosságú.
A Porfestés További Előnyei
- Tartósság: A porfestett felület rendkívül tartós és ellenálló a karcolásokkal, kopással és UV-sugárzással szemben.
- Esztétikai sokszínűség: A porfestés lehetővé teszi a színek és a felületi textúrák széles választékát, így az anyag könnyen illeszkedik a különböző design elképzelésekhez.
- Környezetbarát: A porfestési eljárás általában kevesebb illékony szerves vegyületet (VOC) bocsát ki, mint a hagyományos festési módszerek.
- Egyenletes bevonat: A porfestés egyenletes és sima felületet eredményez.
Az Alu Lochblech Porfestett Alkalmazási Területei
A porfestett alu lyukacsos lemezek felhasználási területe rendkívül széleskörű. Néhány példa:
- Építészet: Homlokzatburkolatok, árnyékolók, erkélykorlátok, álmennyezetek.
- Ipar: Szűrők, zajvédő panelek, gépek burkolatai, szellőzőrácsok.
- Bútoripar: Design elemek, polcok, székek.
- Közlekedés: Járművek belső és külső elemei.
- Mezőgazdaság: Szellőztető rendszerek, szárítók.
Az Alu Lochblech Porfestett Árát Befolyásoló Tényezők Részletesen
Az alu lyukacsos lemez porfestett ára számos tényezőtől függ. Ahhoz, hogy pontos képet kapjunk a költségekről, fontos megérteni ezeket a befolyásoló tényezőket:
Az Alumínium Minősége és Ötvözete
Az alumíniumnak számos különböző ötvözete létezik, amelyek eltérő tulajdonságokkal rendelkeznek (pl. szilárdság, korrózióállóság). A felhasznált alumínium ötvözetének típusa jelentősen befolyásolhatja az árát. Például a repülőgépiparban használt, magasabb szilárdságú ötvözetek általában drágábbak, mint az általános célú ötvözetek.
A Lemez Méretei és Vastagsága
Nyilvánvaló, hogy a lemez mérete (hosszúság, szélesség) és vastagsága közvetlenül befolyásolja az árat. Nagyobb méretű és vastagabb lemezek több alapanyagot igényelnek, ezért drágábbak.
A Lyukazás Mintázata és Sűrűsége
A lyukak formája (kör, négyzet, stb.), átmérője és a lyukak közötti távolság (a lyukazás sűrűsége) szintén hatással van az árra. Komplexebb vagy sűrűbb lyukazási mintázatok több gyártási időt és erőforrást igényelhetnek.
A Porfestés Típusa és Színe
A porfestés ára függ a felhasznált porfesték típusától (pl. poliészter, epoxi), a színétől és a felületkezelés típusától (pl. matt, fényes, strukturált). Speciális színek vagy felületkezelések magasabb költségekkel járhatnak.
A Rendelés Mennyisége
A legtöbb beszállító mennyiségi kedvezményeket kínál. Nagyobb mennyiségű rendelés esetén az egy négyzetméterre jutó ár általában alacsonyabb.
A Beszállító és a Gyártó
Az árak a különböző beszállítók és gyártók között is eltérhetnek. A piaci verseny, a márka presztízse és a nyújtott szolgáltatások (pl. egyedi méretre vágás, szállítás) mind befolyásolhatják az árat.
Egyéb Munkálatok
Ha a lemezekkel kapcsolatban további munkálatokra van szükség (pl. vágás, hajlítás, élmegmunkálás), ezek is hozzáadódnak a végső árhoz.

Árkalkuláció: Hogyan Számoljuk Ki az Alu Lochblech Porfestett Árát?
Az alu lyukacsos lemez porfestett árának pontos kiszámítása összetett lehet, mivel sok tényezőtől függ. Azonban bemutatunk egy általános megközelítést és néhány példát a jobb megértés érdekében.
Alapvető Képlet
A legegyszerűbb megközelítés a következő:

$$\text{Teljes ár} = (\text{Alapanyag ár/m}^2 + \text{Lyukazás költsége/m}^2 + \text{Porfestés költsége/m}^2) \times \text{Lemez területe (m}^2) + \text{Egyéb költségek}$$
Fontos megjegyezni, hogy ez egy leegyszerűsített képlet, és a valóságban a beszállítók eltérő árazási modelleket alkalmazhatnak.

Példa Árkalkuláció
Tegyük fel, hogy szeretnénk vásárolni egy 1 méter széles és 2 méter hosszú (2 m²) alu lyukacsos lemezt, porfestett kivitelben. A becsült költségek a következők lehetnek:
- Alapanyag ár (alumínium): 8.000 Ft/m²
- Lyukazás költsége: 2.000 Ft/m²
- Porfestés költsége: 4.000 Ft/m²
- Egyéb költségek (pl. vágás): 1.000 Ft

Ebben az esetben a teljes ár:
$$(8.000 \text{ Ft/m}^2 + 2.000 \text{ Ft/m}^2 + 4.000 \text{ Ft/m}^2) \times 2 \text{ m}^2 + 1.000 \text{ Ft} = 14.000 \text{ Ft/m}^2 \times 2 \text{ m}^2 + 1.000 \text{ Ft} = 28.000 \text{ Ft} + 1.000 \text{ Ft} = 29.000 \text{ Ft}$$
Ez csak egy példa, a tényleges árak eltérhetnek a piaci viszonyoktól és a beszállítótól függően.
Hogyan Kérjünk Árajánlatot?
A legpontosabb árajánlatért vegye fel a kapcsolatot több beszállítóval, és adja meg a következő részleteket:
- A lemez méretei (hosszúság, szélesség, vastagság)
- A felhasználni kívánt alumínium ötvözet típusa (ha ismert)
- A lyukazás mintázata és a lyukak mérete
- A porfestés színe (RAL kód) és a felületkezelés típusa
- A szükséges mennyiség
- Egyéb igények (pl. vágás, hajlítás)

Piaci Összehasonlítás: Hol Vásárolhatunk Alu Lochblechet Porfestett Kivitelben?
Számos helyen vásárolhat alu lyukacsos lemezt porfestett kivitelben. Fontos, hogy körültekintően válasszon a beszállítók között, figyelembe véve az árat, a minőséget és a szolgáltatásokat.
Gyártók és Nagykereskedők
Közvetlenül a gyártóktól vagy a nagykereskedőktől történő vásárlás gyakran kedvezőbb árakat eredményezhet, különösen nagyobb mennyiség esetén. Ezek a cégek általában széles termékpalettával rendelkeznek és egyedi igényeket is ki tudnak szolgálni.
Építőanyag-kereskedések
Az építőanyag-kereskedésekben is megtalálható a porfestett alu lyukacsos lemez kínálata, bár a választék lehet, hogy korlátozottabb, mint a specializált cégeknél. Azonban kényelmes megoldás lehet kisebb projektekhez.
Online Kiskereskedők
Az online kiskereskedők egyre népszerűbbek, mivel széles választékot kínálnak és gyakran versenyképes árakkal dolgoznak. Vásárlás előtt érdemes elolvasni a vásárlói véleményeket és ellenőrizni a szállítási feltételeket.
Szempontok a Beszállító Kiválasztásakor
- Ár: Hasonlítsa össze több beszállító árait.
- Minőség: Győződjön meg az alapanyag és a porfestés minőségéről.
- Választék: Ellenőrizze, hogy a beszállító rendelkezik-e a szükséges méretekkel,