Elektrod Fogalma
Az Elektród Fogalma: Átfogó Értelmezés és Alkalmazások
Ebben a kimerítő cikkben részletesen feltárjuk az elektród fogalmát, annak alapvető működési elveit, a különböző típusait, azokat az anyagokat, amelyekből készülnek, valamint a legfontosabb alkalmazási területeit a tudomány, az ipar és a mindennapi élet számos területén. Célunk, hogy egy olyan átfogó képet nyújtsunk, amely mindenki számára érthetővé teszi az elektródok jelentőségét, legyen szó akár diákról, kutatóról vagy a téma iránt érdeklődő laikus olvasóról.
Mi Az Az Elektród? Az Alapvető Definíció
Az elektród egy elektromosan vezető anyagból készült alkatrész, amely egy elektromos áramkör és egy nem fémes rész (például elektrolit, vákuum vagy félvezető) között biztosítja az elektromos áram áramlását. Legegyszerűbb formájában egy fémlemez vagy huzal lehet, de komplexebb rendszerekben speciális anyagokból és szerkezetekből épül fel, optimalizálva az adott alkalmazás követelményeinek megfelelően.
Az Elektródok Kulcsfontosságú Szerepe az Elektrokémiai Folyamatokban
Az elektródok központi szerepet játszanak az elektrokémiai folyamatokban, ahol kémiai reakciók mennek végbe elektromos áram hatására vagy elektromos áram termelődik kémiai reakciók révén. Két fő típusa létezik az elektródoknak az elektrokémiai cellákban:
Az Anód: Az Oxidáció Helyszíne
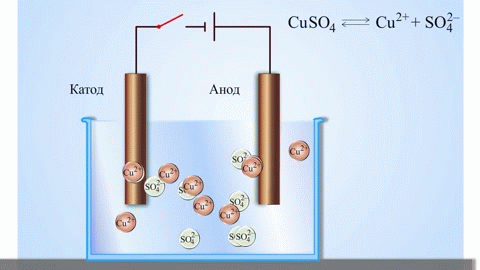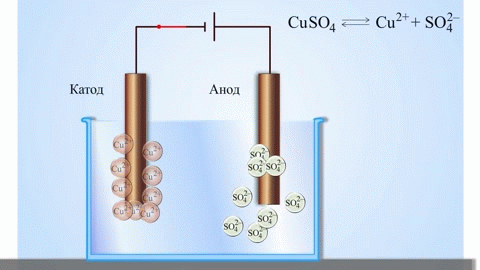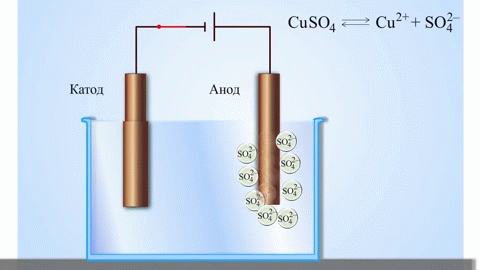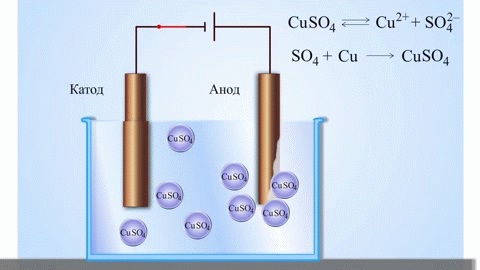
Az anód az az elektród, amelyen az oxidációs folyamat zajlik. Oxidáció során egy anyag elektronokat veszít. Egy galvánelemben (amely spontán kémiai reakciók révén termel elektromos áramot, mint például egy elem) az anód a negatív pólus, ahonnan az elektronok a külső áramkörbe áramlanak. Elektrolízis során (ahol elektromos áramot vezetnek egy oldaton vagy olvadékon keresztül kémiai változások előidézésére) az anód a pozitív pólus, amelyhez az anionok (negatív ionok) vándorolnak, és ahol oxidálódnak.
Az Anód Működési Mechanizmusa Részletesen
Egy galvánelemben az anódon lévő fém atomjai elektronokat adnak le, így pozitív ionokká alakulnak, amelyek az elektrolitba kerülnek. A felszabaduló elektronok a külső áramkörön keresztül a katódhoz áramlanak. Például egy cink-réz galvánelemben a cink elektród az anód:
$$\mathrm{Zn(s) \rightarrow Zn^{2+}(aq) + 2e^- }$$
Elektrolízis során az anódhoz érkező anionok (például kloridionok egy sóoldat elektrolízisekor) elektronokat adnak le, oxidálódnak. Például:
$$\mathrm{2Cl^-(aq) \rightarrow Cl_2(g) + 2e^- }$$
Az anód anyagának megválasztása kritikus fontosságú, függ az adott elektrokémiai rendszer követelményeitől, beleértve a reakciókinetikát és a korrózióállóságot.
A Katód: A Redukció Helyszíne

A katód az az elektród, amelyen a redukciós folyamat zajlik. Redukció során egy anyag elektronokat vesz fel. Egy galvánelemben a katód a pozitív pólus, ahová az elektronok a külső áramkörből érkeznek, és ahol a redukció bekövetkezik. Elektrolízis során a katód a negatív pólus, amelyhez a kationok (pozitív ionok) vándorolnak, és ahol redukálódnak.
A Katód Működési Mechanizmusa Részletesen
Egy galvánelemben a katódnál lévő ionok (vagy molekulák) a külső áramkörből érkező elektronokat felveszik, és redukálódnak. A cink-réz galvánelemben a réz elektród a katód, ahol a réz(II)-ionok redukálódnak:
$$\mathrm{Cu^{2+}(aq) + 2e^- \rightarrow Cu(s)}$$

Elektrolízis során a katódhoz érkező kationok (például nátriumionok olvadt só elektrolízisekor) elektronokat vesznek fel, redukálódnak. Például:
$$\mathrm{Na^+(l) + e^- \rightarrow Na(l)}$$
A katód anyagának kiválasztása szintén kulcsfontosságú, befolyásolja a reakció sebességét és a mellékreakciók elkerülését.
Az Elektródok Anyagai: A Sokféleség és a Funkcionalitás
Az elektródok készülhetnek számos különböző anyagból, attól függően, hogy milyen alkalmazásra szánják őket. A leggyakrabban használt anyagok közé tartoznak a fémek, a szén különböző allotrópjai (például grafit, szénszál), valamint bizonyos félvezető anyagok és polimerek.
Fém Elektródok: A Klasszikus Választás
A fém elektródok széles körben elterjedtek kiváló elektromos vezetőképességük és viszonylag egyszerű előállításuk miatt. Különböző fémeket használnak elektródként, mint például a réz, a cink, az ezüst, a platina és az arany. A fém megválasztása függ az elektrokémiai rendszerben zajló reakcióktól és a kívánt stabilitástól.
Nemesfémek az Elektródokban
A nemesfémek, mint a platina és az arany, különösen kedveltek olyan alkalmazásokban, ahol magas kémiai inertségre van szükség, mivel ellenállnak a korróziónak és nem vesznek részt nem kívánt reakciókban. Gyakran használják őket referencia elektródokként és katalizátorként elektrokémiai folyamatokban.
Aktív Fémek az Elektródokban
Az aktív fémek, mint a cink és a lítium, elengedhetetlenek az akkumulátorokban, ahol nagy energiasűrűségre van szükség. Ezek a fémek könnyen oxidálódnak, így nagy mennyiségű elektron leadására képesek.
Szén Alapú Elektródok: Sokoldalúság és Megfizethetőség
A szén alapú elektródok, különösen a grafit és a szénszál, szintén elterjedtek elektrokémiai alkalmazásokban. Jó elektromos vezetőképességgel rendelkeznek, kémiailag viszonylag inertnek mondhatók, és költségük kedvezőbb a nemesfémekhez képest. Használják őket akkumulátorokban, üzemanyagcellákban és szenzorokban.
Grafit Elektródok
A grafit elektródok mechanikailag stabilak és jól megmunkálhatók. Réteges szerkezetük lehetővé teszi ionok interkalációját (beékelődését), ami fontos az akkumulátorok működésében.
Szénszál Elektródok
A szénszál elektródok nagy felületük miatt előnyösek olyan alkalmazásokban, ahol nagy reakciósebességre van szükség, például bioszenzorokban.
Félvezető Elektródok: A Fény és Az Elektrokémia Találkozása
A félvezető elektródok, mint például a titán-dioxid ($\mathrm{TiO_2}$) és a szilícium ($\mathrm{Si}$), különleges tulajdonságokkal rendelkeznek, amelyek lehetővé teszik a fényelektrokémiai alkalmazásokat, például a napelemeket és a fotokatalízist. Fény hatására elektron-lyuk párok keletkeznek a félvezetőben, amelyek részt vehetnek redox reakciókban az elektród felületén.
Polimer Elektródok: A Rugalmasság és a Biokompatibilitás
A polimer elektródok újabb fejlesztések eredményei, amelyek rugalmasságot és biokompatibilitást kínálnak. Vezetőképes polimereket használnak például bioelektronikai eszközökben és rugalmas akkumulátorokban.
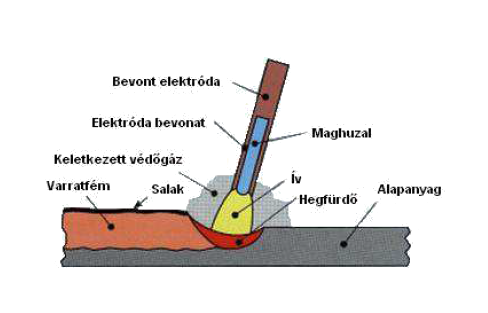
Az Elektródok Típusai Alkalmazás Szerint
Az elektródokat különböző szempontok szerint csoportosíthatjuk. Az elektrokémiai cellákban betöltött szerepük (anód vagy katód) mellett megkülönböztethetünk speciális típusokat is az alkalmazási területük alapján.
Referencia Elektródok: A Potenciál Mérésének Alapja
A referencia elektródok olyan elektródok, amelyek potenciálja ismert és stabil. Ezeket használják más elektródok potenciáljának mérésére elektrokémiai kísérletekben. Néhány gyakori referencia elektród a standard hidrogén elektród (SHE), a kalomel elektród és az ezüst/ezüst-klorid elektród.
A Standard Hidrogén Elektród (SHE)
A standard hidrogén elektród (SHE) a többi elektródpotenciál mérésének alapja. Definíció szerint a potenciálja 0 V standard körülmények között (298 K, 1 atm hidrogéngáz, 1 M $\mathrm{H^+}$ ion koncentráció). Egy platina elektródból áll, amelyet hidrogéngázzal buborékoltatnak át egy savas oldatban.
A Kalomel Elektród
A kalomel elektród egy gyakran használt referencia elektród, amely higanyból, higany(I)-kloridból (kalomel) és egy kloridionokat tartalmazó oldatból áll. Potenciálja a kloridion koncentrációjától függ.
Az Ezüst/Ezüst-Klorid Elektród
Az ezüst/ezüst-klorid elektród egy másik elterjedt referencia elektród, amely egy ezüstdrótból áll, amelyet ezüst-klorid réteg borít, és egy kloridionokat tartalmazó oldatba merítik. Stabil és könnyen használható.
Munkalelektródok: Ahol A Reakció Történik
A munkalelektródok azok az elektródok, ahol a vizsgált elektrokémiai reakció ténylegesen végbemegy. Ezek lehetnek különböző anyagokból és formákból, a kísérlet vagy az alkalmazás követelményeitől függően.

Segédelektródok: Az Áramkör Bezárása
Egy háromelektródos elektrokémiai cellában a segédelektród (vagy ellen-elektród) arra szolgál, hogy az áramkört bezárja a munkalelektróddal, anélkül, hogy a segédelektród potenciálját kontrollálnák vagy mérnék.
Az Elektródok Alkalmazási Területei: A Mindennapi Élettől a Csúcstechnológiáig
Az elektródok nélkülözhetetlenek számos technológiai területen. Az alábbiakban néhány fontosabb alkalmazási területet tekintünk át.
Akkumulátorok és Elemek: Az Energiatárolás Alapjai
Az akkumulátorok és az elemek elektrokémiai cellák, amelyek elektródokat használnak az elektromos energia kémiai energiává történő átalakítására (töltéskor) és vissza (kisütéskor). A legelterjedtebb akkumulátortípusokban (például lítium-ion, nikkel-metál-hidrid) különböző anyagokból készült anódok és katódok találhatók, amelyek között elektrolit biztosítja az ionok áramlását.
Lítium-ion Akkumulátorok Elektródjai
A lítium-ion akkumulátorokban tipikusan grafitot használnak az anódhoz, és fém-oxidokat (például lítium-kobalt-oxid, lítium-vas-foszfát) a katódhoz. A lítium-ionok mozgása az elektródok között teszi lehetővé a töltést és a kisütést.
Elektrolízis: Kémiai Anyagok Előállítása Elektromos Árammal
Az elektrolízis egy olyan folyamat, amelynek során elektromos áramot vezetnek egy elektroliton keresztül, hogy nem spontán kémiai reakciókat idézzenek elő. Az elektródok (anód és katód) itt kulcsszerepet játszanak a reakciók felületének biztosításában. Például a víz elektrolízisével hidrogént és oxigént állítanak elő, a sóolvadékok elektrolízisével pedig tiszta fémeket, mint az alumínium.
Galvánelemek (Voltaikus Cellák): Elektromos Áram Kémiai Reakciókból
A galvánelemek (vagy voltaikus cellák) olyan eszközök, amelyek spontán redox reakciók energiáját elektromos energiává alakítják. Két különböző fémből készült elektródot tartalmaznak, amelyek elektroliton keresztül vannak összekötve. A legismertebb példa a Daniell-elem (cink-réz elem).
Szenzorok: Kémiai és Biológiai Anyagok Érzékelése
Az elektrokémiai szenzorok elektródokat használnak a különböző kémiai és biológiai anyagok koncentrációjának vagy jelenlétének mérésére. A mérendő anyag reakcióba lép az elektród felületén, ami elektromos jel változását eredményezi, amelyet aztán detektálni lehet. Ilyen szenzorokat használnak például a vércukorszint mérésére (glükóz-elektród) vagy a környezeti monitoringban.
Bioszenzorok

A bioszenzorok speciális elektrokémiai szenzorok, amelyek biológiai elemeket (például enzimeket, antitesteket) tartalmaznak a célanyag nagy
Kemiai Hatas Wikipedia
A Kémiai Hatások Átfogó Tanulmánya: Elmélet és Alkalmazások
A kémiai hatások a természet és a technológia számtalan területén alapvető szerepet játszanak. Ebben a részletes tanulmányban mélyrehatóan feltárjuk a kémiai reakciók és jelenségek sokféleségét, azok mechanizmusait, energetikáját és gyakorlati alkalmazásait. Célunk, hogy egy átfogó képet nyújtsunk a kémia ezen központi témájáról, amely elengedhetetlen a természeti folyamatok megértéséhez és az innovatív technológiák fejlesztéséhez.
A Kémiai Reakciók Alapjai
Minden kémiai hatás egy vagy több kémiai reakció eredménye. A kémiai reakciók során atomok és molekulák közötti kötések szakadnak fel és újak jönnek létre. Ezek a folyamatok megváltoztatják az anyagok összetételét és tulajdonságait. A kémiai reakciók megértéséhez elengedhetetlen a sztöchiometria, a reakciókinetika és a termodinamika alapjainak ismerete.
Sztöchiometria: Az Anyagmennyiségek Tana
A sztöchiometria a kémiai reakciókban részt vevő anyagok mennyiségi viszonyaival foglalkozik. Lehetővé teszi számunkra, hogy egy adott reakcióegyenlet alapján kiszámítsuk a reagáló anyagok és a termékek tömegét, mólszámát és térfogatát. A sztöchiometriai számítások alapját a tömegmegmaradás törvénye képezi, amely kimondja, hogy egy zárt rendszerben a reakciók során az anyag tömege nem változik.
A Mól Fogalma és Számításai
A mól az anyagmennyiség SI-egysége. Egy mól az annyi elemi egységet (atomot, molekulát, iont stb.) tartalmaz, mint amennyi atom található 0,012 kilogramm szén-12 izotópban. Ez a szám az Avogadro-szám (N\_A \\approx 6\.022 \\times 10^\{23\} \\text\{ mol\}^\{\-1\}). A móltömeg egy anyag egy móljának tömege, amelyet általában gramm/mól egységben adunk meg.
Példák Sztöchiometriai Számításokra
Vegyük például a hidrogén és az oxigén reakcióját, amely vizet képez:
2H\_2\(g\) \+ O\_2\(g\) \\rightarrow 2H\_2O\(l\)
Ha tudjuk, hogy 4 gramm hidrogén reagál, akkor a sztöchiometriai egyenlet alapján kiszámíthatjuk a szükséges oxigén mennyiségét és a keletkező víz tömegét. A hidrogén móltömege kb. 1 g/mol, így 4 gramm hidrogén 4 molnak felel meg. Az egyenlet szerint 2 mol hidrogénhez 1 mol oxigén szükséges, tehát 4 mol hidrogénhez 2 mol oxigén szükséges. Az oxigén móltömege kb. 32 g/mol, így 2 mol oxigén tömege 64 gramm. A keletkező víz mólszáma megegyezik a hidrogén mólszámával, azaz 4 mol. A víz móltömege kb. 18 g/mol, így 4 mol víz tömege 72 gramm.
Reakciókinetika: A Reakciók Sebessége
A reakciókinetika a kémiai reakciók sebességével és a reakciósebességet befolyásoló tényezőkkel foglalkozik. A reakciósebesség azt mutatja meg, hogy egy adott időegység alatt mennyi reaktáns alakul át termékké. Számos tényező befolyásolhatja a reakciósebességet, beleértve a koncentrációt, a hőmérsékletet, a felület nagyságát és a katalizátorok jelenlétét.
A Reakciósebesség Meghatározása
A reakciósebességet általában a reaktánsok koncentrációjának csökkenésével vagy a termékek koncentrációjának növekedésével fejezzük ki az idő függvényében. Egy általános reakcióra:
aA \+ bB \\rightarrow cC \+ dD
a reakciósebesség kifejezhető például az A reaktáns eltűnésének sebességével:
v \= \-\\frac\{1\}\{a\} \\frac\{d\[A\]\}\{dt\}
vagy a C termék megjelenésének sebességével:
v \= \\frac\{1\}\{c\} \\frac\{d\[C\]\}\{dt\}
A negatív előjel a reaktánsok csökkenését, a pozitív pedig a termékek növekedését jelzi.
A Reakciósebességet Befolyásoló Tényezők
- Koncentráció: Általában a reaktánsok koncentrációjának növelése növeli a reakciósebességet, mivel több részecske ütközhet egymással.
- Hőmérséklet: A hőmérséklet emelése általában növeli a reakciósebességet, mivel több részecskének lesz elegendő energiája az aktivációs energiagát leküzdéséhez.
- Felület nagysága: Heterogén reakciók esetén (ahol a reaktánsok különböző fázisban vannak) a nagyobb felület növeli a reakciósebességet.
- Katalizátorok: A katalizátorok olyan anyagok, amelyek megnövelik a reakciósebességet anélkül, hogy maguk elfogynának a reakció során. A katalizátorok csökkentik az aktivációs energiát.
Termodinamika: Az Energia és a Reakciók Iránya
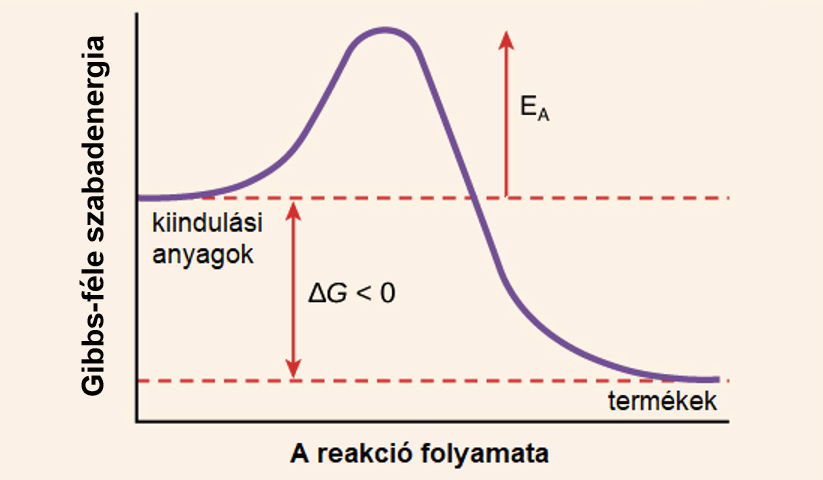
A kémiai termodinamika a kémiai reakciókhoz kapcsolódó energiaváltozásokkal és a reakciók spontaneitásával foglalkozik. Két fontos fogalom a Gibbs-szabadenergia (\\Delta G) és az entalpia (\\Delta H). A Gibbs-szabadenergia megmutatja, hogy egy reakció adott hőmérsékleten és nyomáson spontán végbemegy-e (\\Delta G < 0), egyensúlyban van-e (\\Delta G \= 0), vagy nem spontán (\\Delta G \> 0). Az entalpia a rendszer belső energiájának és a nyomás-térfogat szorzatának összege, és a reakciók hőváltozásait írja le.
Entalpiaváltozás (\\Delta H)

Az entalpiaváltozás egy kémiai reakció során felszabaduló vagy elnyelt hőmennyiséget jelzi állandó nyomáson. Exoterm reakciók esetén (\\Delta H < 0) hő szabadul fel, míg endoterm reakciók esetén (\\Delta H \> 0) hő nyelődik el.
Entrópiaváltozás (\\Delta S)
Az entrópiaváltozás a rendszer rendezetlenségének vagy szabadságfokának változását méri. A természetes folyamatok általában az entrópia növekedése irányába haladnak (\\Delta S \> 0).
Gibbs-szabadenergia-változás (\\Delta G)
A Gibbs-szabadenergia-változás kombinálja az entalpia- és az entrópiaváltozást a reakció spontaneitásának megjóslására:
\\Delta G \= \\Delta H \- T\\Delta S

ahol T a hőmérséklet Kelvinben.
A Kémiai Hatások Főbb Típusai

A kémiai hatásokat számos szempont szerint csoportosíthatjuk. Tekintsük át a legfontosabb kategóriákat:
Sav-bázis Reakciók
A sav-bázis reakciók során protonátmenet történik egy savról egy bázisra. A savak protondonorok, a bázisok protonakceptorok. A legismertebb sav-bázis elméletek az Arrhenius-, a Brønsted-Lowry- és a Lewis-elmélet.
Arrhenius-elmélet
Az Arrhenius-elmélet szerint a savak vízben hidrogénionokat (H^\+), a bázisok pedig hidroxidionokat (OH^\-) képeznek.
Brønsted-Lowry-elmélet
A Brønsted-Lowry-elmélet tágabb értelmezést ad a savaknak és bázisoknak. Ebben az elméletben a savak protondonorok, a bázisok pedig protonakceptorok, függetlenül attól, hogy vízben történik-e a reakció.
Lewis-elmélet
A Lewis-elmélet a legáltalánosabb sav-bázis definíciót adja. A Lewis-savak elektronpár-akceptorok, a Lewis-bázisok pedig elektronpár-donorok.
Redox Reakciók
A redox reakciók (redukció-oxidáció) elektronátmenettel járnak. Az oxidáció során egy anyag elektronokat veszít (oxidációs száma nő), míg a redukció során egy anyag elektronokat vesz fel (oxidációs száma csökken). Az oxidáció és a redukció mindig együtt történik.
Oxidációs Szám
Az oxidációs szám egy atom formális töltése egy vegyületben, feltételezve, hogy minden kötés ionos. Az oxidációs számok nyomon követése segít azonosítani, hogy mely atomok oxidálódnak és melyek redukálódnak egy reakcióban.
Redukálószerek és Oxidálószerek
A redukálószer az az anyag, amely elektronokat ad le (és maga oxidálódik), míg az oxidálószer az az anyag, amely elektronokat vesz fel (és maga redukálódik).
Csapadékképződési Reakciók
A csapadékképződési reakciók során két oldható ionos vegyület reagál egymással, és egy oldhatatlan ionos vegyület, a csapadék keletkezik.
Oldhatósági Szabályok
Az oldhatósági szabályok segítenek megjósolni, hogy egy adott ionos vegyület vízben oldható-e vagy sem. Például az alkálifémek sói és a nitrátok általában oldhatók.
Komplexképződési Reakciók
A komplexképződési reakciók során egy központi fémion ligandumokkal (olyan ionokkal vagy molekulákkal, amelyek nemkötő elektronpárral rendelkeznek) kapcsolódik, komplex iont képezve.
Ligandumok és Koordinációs Szám
A ligandumok a központi fémionhoz kapcsolódó ionok vagy molekulák. A koordinációs szám megadja, hogy a központi fémionhoz hány ligandum kapcsolódik.
Fontos Kémiai Jelenségek és Hatások
A kémiai reakciókon túl számos fontos kémiai jelenség és hatás létezik, amelyek alapvetőek a természet és a technológia szempontjából.
Katalízis
A katalízis az a folyamat, amely során egy katalizátor megnöveli egy kémiai reakció sebességét anélkül, hogy maga elfogyna a reakcióban. A katalizátorok alternatív reakcióutat biztosítanak alacsonyabb aktivációs energiával.
Homogén és Heterogén Katalízis
A homogén katalízis során a katalizátor és a reaktánsok azonos fázisban vannak, míg a heterogén katalízis során különböző fázisban.
Enzimek mint Biológiai Katalizátorok
Az enzimek a biológiai rendszerekben található fehérje alapú katalizátorok, amelyek rendkívül specifikusak és hatékonyak a biokémiai reakciók katalizálásában.
Elektrokémia
Az elektrokémia az elektromos és kémiai jelenségek közötti kapcsolatot vizsgálja. Ide tartoznak az elektrokémiai cellák (galvánelemek és elektrolizáló cellák) és az elektrolízis.
Galvánelemek
A galvánelemek (vagy voltaikus cellák) spontán redox reakciók segítségével elektromos energiát termelnek.
Elektrolizáló Cellák

Az elektrolizáló cellák elektromos energiát használnak nem spontán kémiai reakciók előidézésére (elektrolízis).
Kolloidok
A kolloidok olyan rendszerek, amelyekben egy anyag finoman eloszlatva van egy másik anyagban, de nem oldódik fel teljesen. A kolloid részecskék mérete 1 és 1000 nanométer között van.
Kolloidok Típusai
Vannak szolok (szilárd diszpergálva folyadékban), emulziók (folyadék diszpergálva folyadékban), habok (gáz diszpergálva folyadékban) és aeroszolok (szilárd vagy folyékony diszpergálva gázban).
Kemiai Hatas Fizika
A Kémiai Hatás és a Fizika Összefüggései: Átfogó Tanulmány
A kémiai hatások és a fizikai jelenségek elválaszthatatlanul összefonódnak a természet legmélyebb szintjein. Minden kémiai változás mögött fizikai törvényszerűségek állnak, és minden fizikai folyamat befolyásolhatja az anyag kémiai viselkedését. Ebben a részletes tanulmányban feltárjuk ezt a komplex kölcsönhatást, a mikroszkopikus atomi és molekuláris szinttől kezdve egészen a makroszkopikus világ megfigyelhető jelenségeiig.
Az Atomok és Molekulák Fizikai Alapjai a Kémiai Reakciókban
A kémiai reakciók lényegében az atomok közötti kötések átrendeződései. Ezek a kötések elektromágneses kölcsönhatásokon alapulnak, amelyek a fizika alapvető erői közé tartoznak. Az atommagok pozitív töltése és az elektronok negatív töltése közötti vonzóerő tartja össze az atomokat, míg a molekulákban az atomok közötti megosztott elektronok (kovalens kötés) vagy az ionos töltések közötti vonzóerő (ionos kötés) biztosítja a stabilitást. A kémiai hatás ebben az értelemben nem más, mint ezen elektromágneses kölcsönhatások megnyilvánulása.
Az Elektronkonfiguráció és a Kémiai Tulajdonságok Fizikai Magyarázata
Az atomok elektronkonfigurációja, azaz az elektronok elrendeződése az atommag körül, döntően befolyásolja az adott elem kémiai tulajdonságait. A külső elektronhéjon található elektronok (vegyértékelektronok) felelősek a kémiai kötések kialakításáért. A nemesgázok telített elektronhéjuk miatt rendkívül stabilak és nem hajlamosak reakcióba lépni más elemekkel. Ezt a stabilitást a fizika törvényei magyarázzák, nevezetesen az alacsonyabb energiájú állapotra való törekvés. Amikor atomok kémiai kötést hoznak létre, általában stabilabb, alacsonyabb energiájú konfigurációt érnek el.
Az Ionizációs Energia és az Elektronegativitás Fizikai Gyökerei
Az ionizációs energia, azaz az egy elektron eltávolításához szükséges energia egy semleges atomból, szorosan összefügg az elektronok atommaghoz való kötődésének erősségével. Minél erősebben kötődnek az elektronok, annál magasabb az ionizációs energia. Ezt az erőt a mag töltése és az elektronok távolsága határozza meg, amelyek fizikai mennyiségek. Az elektronegativitás, egy atom azon képessége, hogy egy kovalens kötésben megossza az elektronokat maga felé vonzza, szintén az atommag töltésén és a kötésben részt vevő elektronok távolságán múlik. Tehát mindkét alapvető kémiai fogalom fizikai alapokon nyugszik.

A Molekulák Geometriája és a Fizikai Kölcsönhatások
A molekulák térbeli szerkezete, azaz a molekulageometria, kulcsszerepet játszik az anyagok fizikai tulajdonságaiban, mint például az olvadáspont, forráspont, oldhatóság és reakcióképesség. A molekulageometriát a központi atom körüli elektronpárok taszítása (VSEPR-elmélet) határozza meg, ami végső soron az elektronok és az atommagok közötti elektromágneses kölcsönhatások eredménye. A molekulák polaritása, amely szintén befolyásolja a fizikai kölcsönhatásokat (például a dipól-dipól kölcsönhatásokat), a molekula geometriájától és az atomok elektronegativitásának különbségétől függ.
Intermolekuláris Erők: A Makroszkopikus Fizikai Tulajdonságok Kémiai Gyökerei
Az intermolekuláris erők, amelyek a molekulák között hatnak, felelősek az anyagok makroszkopikus fizikai tulajdonságaiért. Ide tartoznak a van der Waals-erők (London-diszperziós erők, dipól-dipól kölcsönhatások, hidrogénkötés). Ezek az erők mind elektromágneses eredetűek és erősségük befolyásolja az anyagok halmazállapotát, viszkozitását, felületi feszültségét stb. A kémiai szerkezet (a molekulák alakja és polaritása) közvetlenül meghatározza az intermolekuláris erők erősségét, így a kémia és a fizika itt is szorosan összekapcsolódik.
Energia és Kémiai Változások: A Termodinamika és a Kinetika Fizikai Alapjai
Minden kémiai reakció energiaváltozással jár. A termodinamika azzal foglalkozik, hogy egy reakció spontán lejátszódik-e és mennyi energia szabadul fel vagy nyelődik el. A kinetika pedig a reakció sebességét és a reakciómechanizmust vizsgálja. Mindkét terület mélyen gyökerezik a fizika törvényeiben.
A Termodinamika Első Főtétele és a Kémiai Reakciók Hőmérlege
A termodinamika első főtétele, az energia megmaradásának elve, alapvető a kémiai reakciók energiaváltozásainak megértéséhez. Egy zárt rendszerben az energia nem vész el és nem keletkezik, csak átalakulhat egyik formából a másikba. A kémiai reakciókban a belső energia megváltozása a rendszerrel közölt vagy általa leadott hő és a rendszeren végzett vagy általa végzett munka összege. Az entalpiaváltozás ($\Delta H$), amely állandó nyomáson lejátszódó reakciók hőváltozását jelzi, kulcsfontosságú a reakciók exoterm (hőt felszabadító) vagy endoterm (hőt elnyelő) jellegének meghatározásában.
A Termodinamika Második Főtétele és a Spontaneitás
A termodinamika második főtétele bevezeti az entrópia fogalmát, amely a rendszer rendezetlenségének mértéke. Egy spontán folyamat mindig a rendszer és a környezet teljes entrópiájának növekedésével jár. A kémiai reakciók spontaneitását a Gibbs-szabadenergia ($\Delta G$) változása határozza meg, amely az entalpiaváltozást és az entrópiaváltozást is figyelembe veszi ($\Delta G = \Delta H – T\Delta S$). A negatív Gibbs-szabadenergia-változás spontán reakciót jelez.
A Kémiai Kinetika és a Reakciósebesség Fizikai Meghatározottsága
A kémiai kinetika a kémiai reakciók sebességével és mechanizmusával foglalkozik. A reakciósebességet számos tényező befolyásolja, beleértve a reaktánsok koncentrációját, a hőmérsékletet és a katalizátorok jelenlétét. A reakciók sebességét a fizikai körülmények (hőmérséklet, nyomás) és a reaktáns molekulák közötti ütközések gyakorisága és energiája határozza meg. Az Arrhenius-egyenlet ($k = A e^{ -E_a/RT}$) kvantitatívan írja le a hőmérséklet hatását a reakciósebességi állandóra, ahol $E_a$ az aktiválási energia, amely a reakció beindulásához szükséges minimális energia.
A Katalizátorok Fizikai Működési Elve
A katalizátorok olyan anyagok, amelyek megnövelik a kémiai reakciók sebességét anélkül, hogy maguk elfogynának a reakció során. Ezt úgy érik el, hogy egy alacsonyabb aktiválási energiájú reakcióutat biztosítanak. A katalizátorok működése gyakran fizikai kölcsönhatásokon alapul, például a reaktáns molekulák adszorpcióján a katalizátor felületén, ami megkönnyíti a kötések gyengülését és az új kötések kialakulását.
A Fény és az Anyag Kölcsönhatása: Spektroszkópia és Fotokémia

A fény és az anyag közötti kölcsönhatás alapvető fontosságú a kémiai szerkezet és a kémiai folyamatok megértéséhez. A spektroszkópiai módszerek a fény anyaggal való kölcsönhatásának mérésén alapulnak, és információt nyújtanak az anyagok atomi és molekuláris szerkezetéről. A fotokémia pedig a fény által kiváltott kémiai reakciókat tanulmányozza.
Az Elektromágneses Spektrum és a Kémiai Információ
Az elektromágneses spektrum különböző hullámhosszúságú elektromágneses sugárzásból áll. A különböző hullámhosszúságú fény másképpen lép kölcsönhatásba az anyaggal. Például az infravörös sugárzás a molekulák vibrációs mozgásait gerjeszti, az ultraibolya és látható fény az elektronokat gerjeszti, a röntgensugárzás pedig a belső elektronhéjakra hat. A kibocsátott vagy elnyelt fény spektrumának elemzése részletes információt nyújt az anyag kémiai összetételéről és szerkezetéről.
A Fotokémiai Reakciók Fizikai Mechanizmusai
A fotokémiai reakciók akkor következnek be, amikor egy molekula elnyel egy fotont, és ennek hatására gerjesztett állapotba kerül. Ebben a magasabb energiájú állapotban a molekula másképpen reagálhat, mint az alapállapotban. A fizikai folyamatok, mint például a gerjesztett állapot élettartama és a különböző deaktíválódási utak (fluoreszcencia, foszforeszcencia, hőleadás), befolyásolják a fotokémiai reakciók hatékonyságát. A fotoszintézis, a növények által a fény energiájának kémiai energiává alakításának folyamata, egy kiemelkedő példa a fotokémiai reakciókra.
Anyag Szerkezete és Tulajdonságai: A Szilárdtestfizika Kémiai Kapcsolatai
Az anyagok makroszkopikus tulajdonságait, mint például a szilárdság, vezetőképesség és mágnesesség, nagymértékben befolyásolja az atomok és molekulák elrendeződése a szilárd fázisban. A szilárdtestfizika és a kémia itt is szorosan együttműködik az anyagok tulajdonságainak megértésében.
Kristályszerkezetek és Kémiai Kötések
A szilárd anyagokban az atomok vagy ionok rendezett, ismétlődő mintázatot alkotnak, amelyet kristályszerkezetnek nevezünk. A kristályszerkezet típusa és a benne lévő kémiai kötések (kovalens, ionos, fémes) alapvetően meghatározzák az anyag fizikai tulajdonságait. Például a gyémántban lévő erős kovalens kötések felelősek a rendkívüli keménységéért, míg a fémekben lévő delokalizált elektronok a jó elektromos vezetőképességért.

A Félvezetők Fizikai és Kémiai Alapjai
A félvezetők olyan anyagok, amelyek elektromos vezetőképessége a vezetők és a szigetelők között van. Vezetőképességük hőmérséklettel és szennyezésekkel (doppingolással) befolyásolható. A félvezetők működése kvantummechanikai jelenségeken alapul, de a kívánt elektromos tulajdonságok eléréséhez a kémiai tisztaság és a pontos doppingolás elengedhetetlen. A félvezető eszközök (diódák, tranzisztorok) a modern elektronika alapját képezik.
Összegzés: A Kémia és a Fizika Szinergiája
Láthattuk, hogy a kémiai hatások és a fizikai jelenségek mélyen összefonódnak. A fizika alapvető törvényei magyarázzák az atomok és molekulák viselkedését, a kémiai kötések kialakulását, az energiaváltozásokat a reakciók során, valamint a fény és az anyag kölcsönhatását. A kémia pedig az anyagok összetételével, szerkezetével, tulajdonságaival és átalakulásaival foglalkozik, amelyek mind fizikai alapokon nyugszanak. A két tudományterület szinergiája nélkülözhetetlen a természet megértéséhez és az új technológiák fejlesztéséhez.

A Jövő Kilátásai: Interdiszciplináris Kutatások
A kémia és a fizika közötti határterületeken folytatott kutatások izgalmas új felfedezésekhez vezetnek. A nanotechnológia, a anyagtudomány és a biofizika olyan területek, ahol a kémiai és fizikai megközelítések elengedhetetlenek az innovációhoz. A jövőben várhatóan még szorosabb lesz ez az együttműködés, ami új anyagok, új eljárások és a természet mélyebb megértéséhez vezethet.
Arrhenius Egyenlet
Az Arrhenius-egyenlet részletes elemzése: A reakciósebesség hőmérsékletfüggése
Bevezetés az Arrhenius-egyenlet világába
A kémiai kinetika egyik alapvető egyenlete az Arrhenius-egyenlet, amely megadja a kémiai reakciók sebességi állandójának hőmérséklettől való függését. Svante Arrhenius svéd kémikus fedezte fel ezt az összefüggést 1889-ben, és azóta is a kémiai reakciók sebességének megértésének és előrejelzésének kulcsfontosságú eszköze. Az egyenlet nem csupán egy matematikai formula; mély betekintést nyújt a molekuláris szintű folyamatokba, amelyek egy kémiai reakció lejátszódásához szükségesek. Megértése elengedhetetlen a kémia, a fizika, a biológia és a mérnöki tudományok számos területén.
Ebben a részletes elemzésben mélyrehatóan feltárjuk az Arrhenius-egyenlet minden aspektusát. Kezdjük az elméleti alapokkal, megvizsgáljuk a mögöttes fizikai és kémiai elveket. Ezt követően részletesen bemutatjuk az egyenlet matematikai formáját és az egyes paraméterek jelentését. Kitérünk az egyenlet levezetésére, a kísérleti meghatározás módszereire, valamint a gyakorlati alkalmazások széles körére. Végül megvizsgáljuk az Arrhenius-egyenlet korlátait és azokat a kiterjesztéseket, amelyek a komplexebb rendszerek leírására szolgálnak.
Célunk, hogy egy átfogó és érthető képet nyújtsunk az Arrhenius-egyenletről, amely nem csupán a diákok és a kutatók számára lehet hasznos, hanem mindenki számára, aki érdeklődik a kémiai reakciók világa iránt. Merüljünk el tehát a reakciósebesség hőmérsékletfüggésének lenyűgöző világában!
Az Arrhenius-egyenlet matematikai formája és paraméterei
Az Arrhenius-egyenlet matematikai formája a következő:
$\displaystyle k = A \cdot e^{ -\frac{E_a}{RT}}$
Ahol:
- $k$ a sebességi állandó, amely megmutatja, hogy egy adott hőmérsékleten milyen gyorsan megy végbe a reakció. Egysége a reakció rendjétől függ.
- $A$ a frekvenciafaktor (vagy pre-exponenciális faktor), amely a molekulák ütközésének gyakoriságát és a megfelelő orientációval történő ütközések arányát képviseli. Egysége megegyezik a sebességi állandó egységével.
- $E_a$ az aktiválási energia, amely az a minimális energia, amelyre a reaktáns molekuláknak szükségük van ahhoz, hogy a reakció végbemenjen. Egysége általában joule/mol (J/mol) vagy kilojoule/mol (kJ/mol).
- $R$ az univerzális gázállandó, amelynek értéke körülbelül 8.314 J/(mol·K).
- $T$ az abszolút hőmérséklet Kelvinben (K).
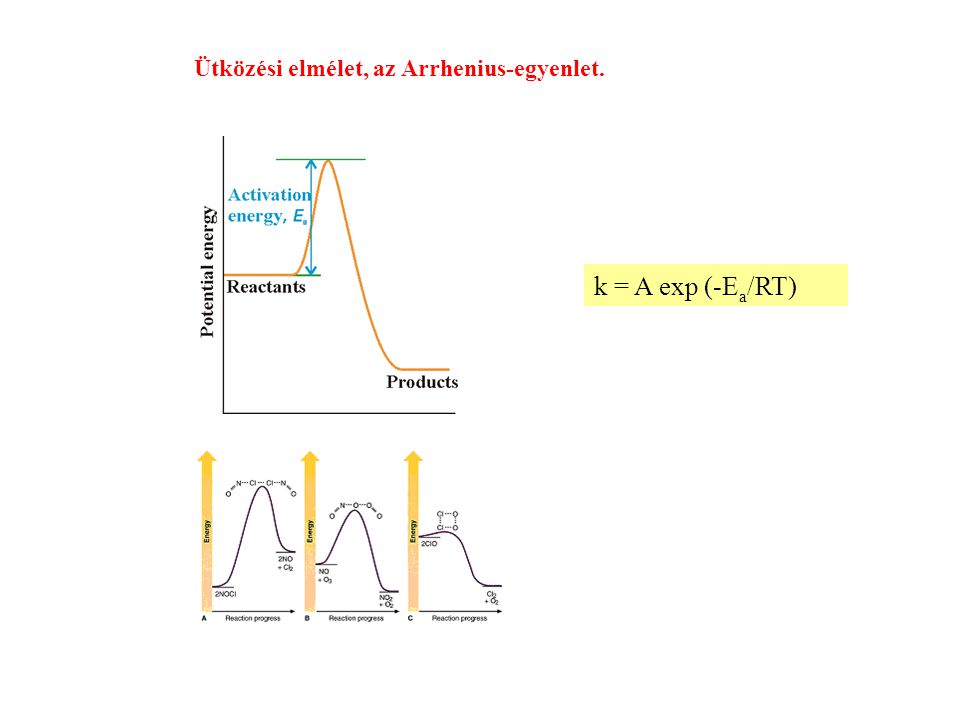
A sebességi állandó (k) jelentősége
A sebességi állandó ($k$) egy kulcsfontosságú mennyiség a kémiai kinetikában. Azt mutatja meg, hogy egy adott reakció milyen gyorsan megy végbe adott körülmények között. Nagyobb sebességi állandó gyorsabb reakciót jelent. Az Arrhenius-egyenlet éppen azt írja le, hogy ez a sebességi állandó hogyan változik a hőmérséklet függvényében.
A frekvenciafaktor (A) részletesebb bemutatása
A frekvenciafaktor ($A$), más néven pre-exponenciális faktor, két fő tényezőt foglal magában: az ütközések gyakoriságát a reaktáns molekulák között, és annak a valószínűségét, hogy egy ütközés megfelelő orientációval történik a reakció lejátszódásához. Az ütközési elmélet alapján az $A$ arányos az ütközések számával egységnyi idő alatt és egységnyi térfogatban. Azonban nem minden ütközés vezet reakcióhoz; a molekuláknak megfelelő orientációban kell ütközniük ahhoz, hogy a kötésátrendeződés megtörténhessen. A frekvenciafaktor ezt az orientációs tényezőt is magában foglalja.
Az aktiválási energia (Ea) mint a reakció gátja
Az aktiválási energia ($E_a$) az a minimális energiakülönbség a reaktánsok és az átmeneti állapot között. A reaktáns molekuláknak elegendő kinetikus energiával kell rendelkezniük ahhoz, hogy legyőzzék ezt az energiagátat és elérjék az átmeneti állapotot, amelyből aztán termékekké alakulhatnak. Magasabb aktiválási energia azt jelenti, hogy kevesebb molekulának van elegendő energiája az átlépéshez, így a reakció lassabb lesz. Az Arrhenius-egyenlet exponenciális tagja ($e^{ -\frac{E_a}{RT}}$) azt mutatja meg, hogy a reakció sebessége rendkívül érzékeny az aktiválási energia értékére.
Az univerzális gázállandó (R) szerepe
Az univerzális gázállandó ($R$) egy fizikai állandó, amely számos termodinamikai és kinetikai egyenletben megjelenik. Az Arrhenius-egyenletben az energia és a hőmérséklet közötti kapcsolatot skálázza. Értéke állandó, és a használt energiaegységektől függően változhat (pl. J/(mol·K) vagy cal/(mol·K)).

A hőmérséklet (T) hatása a reakciósebességre
Az Arrhenius-egyenlet egyik legfontosabb következménye, hogy a reakciósebesség exponenciálisan növekszik a hőmérséklet emelkedésével. Ennek oka az exponenciális tag ($e^{ -\frac{E_a}{RT}}$), amely azt mutatja, hogy ahogy a hőmérséklet nő, egyre több molekulának lesz elegendő energiája az aktiválási energia legyőzéséhez. Ez a jelenség magyarázza, hogy miért gyorsulnak fel a kémiai reakciók melegítés hatására.
Az Arrhenius-egyenlet levezetése
Az Arrhenius-egyenlet levezetéséhez termodinamikai és statisztikus mechanikai megfontolásokra van szükség. Bár a teljes levezetés meglehetősen komplex lehet, bemutatjuk a főbb lépéseket és az alapvető gondolatmenetet.
A sebességi állandó és az egyensúlyi állandó kapcsolata
Tekintsünk egy elemi, megfordítható reakciót:
$\displaystyle A + B \underset{k_{ -1}}{\stackrel{k_1}{\rightleftharpoons}} C$
Ahol $k_1$ az előreirányuló reakció sebességi állandója, $k_{ -1}$ pedig a visszafelé irányuló reakcióé. Az egyensúlyi állandó ($K$) kifejezhető a sebességi állandók hányadosaként:
$\displaystyle K = \frac{k_1}{k_{ -1}}$
A termodinamika szerint az egyensúlyi állandó hőmérsékletfüggését a van’t Hoff-egyenlet írja le:

$\displaystyle \frac{d \ln K}{dT} = \frac{\Delta H^\circ}{RT^2}$
Ahol $\Delta H^\circ$ a standard reakcióentalpia.

Az aktivált komplex elmélet
Az Arrhenius-egyenlet levezetésének egy másik megközelítése az aktivált komplex elmélet (vagy átmeneti állapot elmélet). Ez az elmélet feltételezi, hogy a reaktánsok először egy instabil, magas energiájú átmeneti állapotot (aktivált komplexet) képeznek, mielőtt termékekké alakulnának.
A reakció sématikusan így ábrázolható:
$\displaystyle A + B \rightleftharpoons [AB]^\ddagger \rightarrow C$
Ahol $[AB]^\ddagger$ az aktivált komplex. Az elmélet szerint a sebességi állandó arányos az aktivált komplex koncentrációjával és annak bomlási sebességével a termékek felé.
A levezetés főbb lépései
Bár a részletes matematikai levezetés itt nem fér bele, a lényeg az, hogy a sebességi állandó hőmérsékletfüggése az aktiválási energiával és a hőmérséklettel exponenciális kapcsolatban áll. A levezetés során figyelembe veszik a molekulák energiaeloszlását (Maxwell-Boltzmann eloszlás) és annak a valószínűségét, hogy egy ütköző pár elegendő energiával rendelkezik az aktiválási gát leküzdéséhez.
Az Arrhenius eredeti megközelítése nagyrészt empirikus volt, de később elméleti alapot is kapott a statisztikus mechanika és az aktivált komplex elmélet révén. A lényeg, hogy a reakció sebessége függ attól, hogy hány molekula rendelkezik az aktiválási energiánál nagyobb energiával, és ez a szám exponenciálisan nő a hőmérséklettel.
Az aktiválási energia (Ea) kísérleti meghatározása
Az aktiválási energia ($E_a$) és a frekvenciafaktor ($A$) kísérletileg meghatározható a sebességi állandó ($k$) különböző hőmérsékleteken történő mérésével.
A logaritmikus forma
Az Arrhenius-egyenlet logaritmikus formája a következő:
$\displaystyle \ln k = \ln A – \frac{E_a}{R} \cdot \frac{1}{T}$
Ez az egyenlet egy egyenes vonal egyenletének ($y = mx + b$) felel meg, ahol:
- $y = \ln k$
- $x = \frac{1}{T}$
- $m = -\frac{E_a}{R}$ (a vonal meredeksége)
- $b = \ln A$ (az y-tengelymetszet)
Grafikus módszer
A kísérleti adatok alapján, ha ábrázoljuk $\ln k$-t $1/T$ függvényében, egy egyenes vonalat kapunk. A vonal meredekségéből meghatározható az aktiválási energia:
$\displaystyle E_a = -R \cdot \text{meredekség}$
Az y-tengelymetszetből pedig a frekvenciafaktor számítható ki:
$\displaystyle A = e^{\text{y-tengelymetszet}}$
Kétpontos módszer

Ha a sebességi állandót két különböző hőmérsékleten ismerjük ($k_1$ bei $T_1$ és $k_2$ bei $T_2$), akkor az aktiválási energia közvetlenül is kiszámítható:
$\displaystyle \ln \left( \frac{k_2}{k_1} \right) = \frac{E_a}{R} \left( \frac{1}{T_1} – \frac{1}{T_2} \right)$
Ebből az egyenletből $E_a$ kifejezhető:
$\displaystyle E_a = R \cdot \frac{\ln(k_2/k_1)}{(1/T_1) – (1/T_2)}$
Miután $E_a$ ismert, a frekvenciafaktor ($A$) az eredeti Arrhenius-egyenletből vagy annak logaritmikus formájából számítható ki bármelyik mérési pont felhasználásával.
Az Arrhenius-egyenlet gyakorlati alkalmazásai
Az Arrhenius-egyenletnek rendkívül széles körű gyakorlati alkalmazásai vannak a különböző tudományterületeken és az iparban.
Kémiai reakciók sebességének előrejelzése
Az egyik legfontosabb alkalmazás a kémiai reakciók sebességének előrejelzése különböző hőmérsékleteken, ha az aktiválási energia és a frekvenciafaktor ismert. Ez elengedhetetlen a reaktorok tervezéséhez, a reakciókörülmények optimalizálásához és a termékhozam maximalizálásához.
Reakciómechanizmusok tanulmányozása
Az aktiválási energia értéke betekintést nyújthat a reakciómechanizmusba. Magas aktiválási energia összetett, több lépésből álló reakciót vagy olyan lépést jelezhet, amely jelentős átrendeződést igényel a molekulákban. Alacsony aktiválási energia egyszerűbb mechanizmusra utalhat.
Élettudományok
Az Arrhenius-egyenlet elvét alkalmazzák biológiai folyamatok hőmérsékletfügg
Aktivalt Komplexum
Az Aktivált Komplexum Részletes Tanulmánya
A kémia lenyűgöző világában a reakciók nem csupán azzal kezdődnek és végződnek, hogy a reagensek termékekké alakulnak. Egy láthatatlan, ám annál fontosabb köztes állapot létezik, amelyet aktivált komplexumnak vagy átmeneti állapotnak nevezünk. Ez a pillanatnyi képződmény kulcsfontosságú a kémiai reakciók megértéséhez és irányításához. Ebben a részletes cikkben mélyrehatóan feltárjuk az aktivált komplexum fogalmát, keletkezésének mechanizmusát, tulajdonságait, valamint a kémiai kinetikában és a katalízisben betöltött szerepét.
Mi Az Az Aktivált Komplexum?
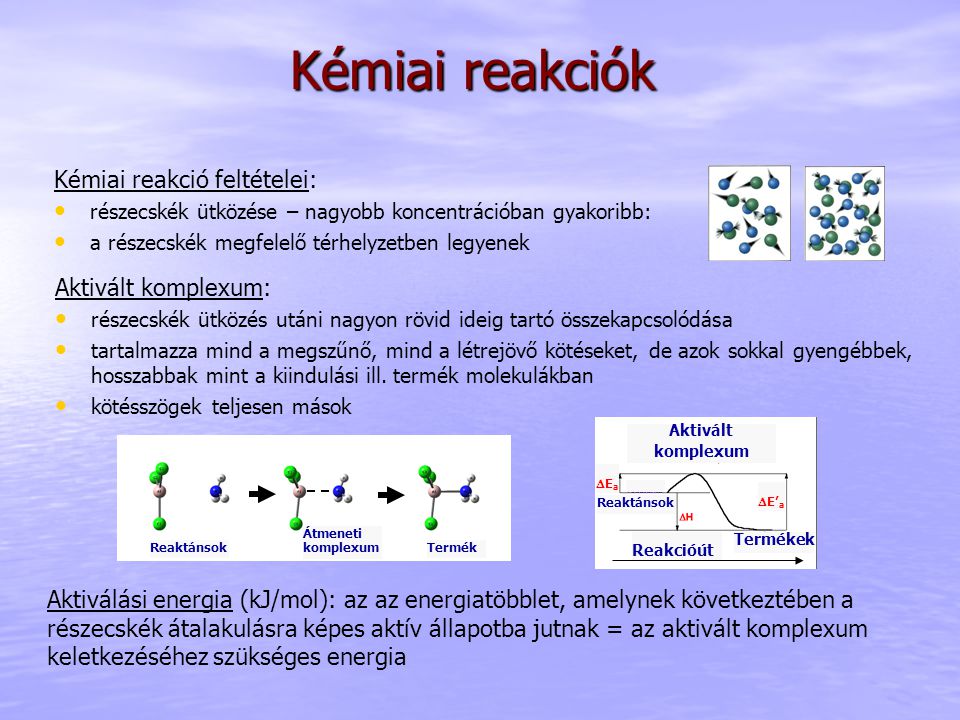
Az aktivált komplexum egy instabil, magas energiájú köztes szerkezet, amely a reagensek ütközésekor és az aktiválási energia leküzdése után jön létre. Ez az átmeneti állapot a régi kötések felbomlásának és az új kötések kialakulásának pillanatát képviseli. Rendkívül rövid élettartamú, és azonnal tovább alakul vagy visszaalakul a reagensekké.
Az Aktivált Komplexum Definíciója és Jellemzői
Pontosabban fogalmazva, az aktivált komplexum egy olyan molekuláris konfiguráció, amely a reakciókoordináta mentén a potenciális energiafelület csúcsán helyezkedik el. Ennek a pontnak a legmagasabb az energiája a reagensek és a termékek energiájához képest. Főbb jellemzői közé tartozik az instabilitás, a magas energiaállapot, valamint a részlegesen kialakult és részlegesen felbomlott kémiai kötések jelenléte.
Az Aktivált Komplexum Keletkezésének Mechanizmusa
Az aktivált komplexum létrejöttéhez a reagens molekuláknak ütközniük kell egymással, és elegendő kinetikus energiával kell rendelkezniük ahhoz, hogy leküzdjék az aktiválási energiát. Ez az energia szükséges a régi kötések meggyengítéséhez és az új kötések kialakításának megkezdéséhez. Az ütközés megfelelő orientációja szintén elengedhetetlen ahhoz, hogy az aktivált komplexum kialakulhasson.
Az Aktivált Komplexum Tulajdonságai
Az aktivált komplexum számos egyedi tulajdonsággal rendelkezik, amelyek megkülönböztetik a reagensektől és a termékektől.
Instabilitás és Rövid Élettartam
Az aktivált komplexum rendkívül instabil, mivel a potenciális energiafelület csúcsán helyezkedik el. Ez azt jelenti, hogy bármilyen kis energiaváltozás hatására vagy termékekké alakul, vagy visszaalakul a reagensekké. Élettartama rendkívül rövid, tipikusan a femtoszekundum (10^-15 s) nagyságrendjébe esik.
Magas Energiaállapot
Az aktivált komplexum energiája magasabb, mint a reagenseké és általában a termékeké is. Ez a többletenergia az aktiválási energia, amely a reakció beindulásához szükséges. Az aktivált komplexum lényegében egy energiagát tetején helyezkedik el, amelyen a reagenseknek át kell jutniuk ahhoz, hogy termékekké alakulhassanak.
Részlegesen Kialakult és Felbomlott Kötések
Az aktivált komplexumban a reagensek közötti régi kötések részlegesen meggyengültek vagy felbomlottak, míg a termékekben kialakuló új kötések részlegesen létrejöttek. Ez a köztes állapot egyfajta “átmenetet” képez a reagensek és a termékek között, ahol a molekulák szerkezete folyamatosan változik.
Az Aktivált Komplexum Képződésének Elméleti Megközelítései
Számos elméleti modell létezik az aktivált komplexum képződésének és tulajdonságainak leírására.
Az Átmeneti Állapot Elmélete (Transition State Theory – TST)
Az átmeneti állapot elmélete az egyik legfontosabb elméleti keret a kémiai reakciók sebességének magyarázatára. Ez az elmélet feltételezi, hogy a reagensek egy átmeneti állapoton keresztül alakulnak át termékekké, és ez az átmeneti állapot az aktivált komplexumnak felel meg. A TST lehetővé teszi a reakciósebességi állandó kiszámítását az aktivált komplexum tulajdonságai alapján.
Az Átmeneti Állapot Elméletének Alapfeltevései
- A reagensek egyensúlyban vannak az aktivált komplexummal.
- Az aktivált komplexum egyetlen rezgési módja a reakciókoordináta mentén történő bomlás a termékekké.
- A klasszikus mechanika alkalmazható a magok mozgásának leírására az átmeneti állapot közelében.

Az Arrhenius-egyenlet és az Átmeneti Állapot Elmélete
Az átmeneti állapot elmélete szoros kapcsolatban áll az Arrhenius-egyenlettel, amely a reakciósebességi állandó hőmérsékletfüggését írja le. A TST egy részletesebb magyarázatot ad az Arrhenius-féle aktiválási energia és a pre-exponenciális faktor jelentésére molekuláris szinten.
$$\Large k = \frac{k_B T}{h} \frac{Q^\ddagger}{Q_A Q_B} e^{ -E_a/RT}$$
Ahol:
- $k$ a reakciósebességi állandó
- $k_B$ a Boltzmann-állandó
- $T$ a hőmérséklet (Kelvin)
- $h$ a Planck-állandó
- $Q^\ddagger$ az aktivált komplexum partíciós függvénye
- $Q_A$ és $Q_B$ a reagensek partíciós függvényei
- $E_a$ az aktiválási energia
- $R$ az univerzális gázállandó

Az Ütközési Elmélet (Collision Theory)
Az ütközési elmélet egy másik megközelítés a reakciósebességek magyarázatára, különösen gázfázisú reakciók esetén. Ez az elmélet azt feltételezi, hogy a reakciók akkor következnek be, ha a reagens molekulák ütköznek egymással elegendő energiával és megfelelő orientációval. Az aktivált komplexum ebben az elméletben az ütközés pillanatában létrejövő instabil konfigurációnak felel meg.
Az Ütközési Elmélet Főbb Pontjai
- A reakció sebessége arányos az ütközések gyakoriságával.
- Csak azok az ütközések eredményeznek reakciót, amelyekben a molekulák elegendő kinetikus energiával rendelkeznek az aktiválási energia leküzdéséhez.
- Az ütközés geometriája (szterikus faktor) befolyásolja a reakció valószínűségét.
Az Aktivált Komplexum Jelentősége a Kémiai Kinetikában
Az aktivált komplexum fogalma központi szerepet játszik a kémiai kinetikában, a kémiai reakciók sebességének és mechanizmusának tanulmányozásában.
Az Aktiválási Energia Meghatározása
Az aktivált komplexum energiája közvetlenül kapcsolódik az aktiválási energiához. Az aktiválási energia az a minimális energia, amelyre a reagens molekuláknak szükségük van ahhoz, hogy elérjék az aktivált komplexum állapotát és így végbemenjen a reakció. Minél alacsonyabb az aktiválási energia, annál gyorsabban megy végbe a reakció adott hőmérsékleten.
A Reakciósebesség Értelmezése
Az aktivált komplexum létezése és tulajdonságai segítenek megérteni, hogy miért függ a reakciósebesség a hőmérséklettől és a koncentrációtól. A magasabb hőmérséklet több molekulának biztosít elegendő energiát az aktivált komplexum eléréséhez, míg a magasabb koncentráció növeli az ütközések gyakoriságát.
A Reakciómechanizmusok Feltárása
Az aktivált komplexumok tanulmányozása kulcsfontosságú a reakciómechanizmusok feltárásában. A reakciómechanizmus egy részletes lépésről lépésre történő leírása annak, hogy a reagensek hogyan alakulnak át termékekké. Az aktivált komplexumok az egyes elemi lépések átmeneti állapotait képviselik.
Az Aktivált Komplexum Szerepe a Katalízisben
A katalizátorok olyan anyagok, amelyek megnövelik a kémiai reakciók sebességét anélkül, hogy maguk elfogynának a reakció során. Ezt úgy érik el, hogy egy alternatív reakcióutat kínálnak alacsonyabb aktiválási energiával, ami egy alacsonyabb energiájú aktivált komplexum képződéséhez vezet.

Homogén és Heterogén Katalízis
Mind a homogén katalízisben (ahol a katalizátor és a reagensek azonos fázisban vannak), mind a heterogén katalízisben (ahol a katalizátor és a reagensek különböző fázisban vannak), az aktivált komplexum képződése kulcsfontosságú lépés.
A Katalizátor Hatásmechanizmusa
A katalizátor úgy csökkenti az aktiválási energiát, hogy stabilizálja az aktivált komplexumot vagy egy alternatív, alacsonyabb energiájú átmeneti állapotot hoz létre. Ezáltal több reagensmolekula rendelkezik elegendő energiával az aktivált komplexum eléréséhez, ami a reakció sebességének növekedéséhez vezet.
Az Aktivált Komplexum Kísérleti Vizsgálata
Bár az aktivált komplexum rendkívül rövid élettartamú, a tudósok számos kísérleti technikát fejlesztettek ki a tulajdonságainak közvetett vagy közvetlen vizsgálatára.
Gyors Kinetikai Módszerek

A gyors kinetikai módszerek, mint például a villanó fotolízis és a relaxációs technikák, lehetővé teszik a nagyon gyors reakciók és a rövid élettartamú intermedier termékek, köztük az aktivált komplexumok tanulmányozását.
Számítógépes Kémia és Modellezés
A számítógépes kémia és a molekuláris modellezés egyre fontosabb szerepet játszik az aktivált komplexumok szerkezetének és energiájának elméleti leírásában. Különböző kvantumkémiai módszerekkel lehetőség nyílik a potenciális energiafelület feltérképezésére és az átmeneti állapotok azonosítására.
Spektroszkópiai Módszerek
Bizonyos spektroszkópiai módszerek, bár nem közvetlenül az aktivált komplexumot detektálják, információt nyújthatnak a reakcióútvonalról és a köztes termékekről, amelyek segíthetnek az aktivált komplexum tulajdonságainak következtetésében.
Összefoglalás
Az aktivált komplexum a kémiai reakciók megértésének egyik kulcsfogalma. Ez a rövid élettartamú, magas energiájú átmeneti állapot hidat képez a reagensek és a termékek között. Tanulmányozása elengedhetetlen a reakciósebességek, a reakciómechanizmusok és a katalízis megértéséhez. Az átmeneti állapot elmélete és az ütközési elmélet elméleti keretet biztosít az aktivált komplexum tulajdonságainak és szerepének leírásához. A kísérleti és számítógépes módszerek pedig egyre több betekintést nyújtanak ebbe a nehezen megfogható, de annál fontosabb kémiai entitásba.
Aktivált Komplexum: A Jövő Kutatásának Irányai
A jövőbeli kutatások várhatóan még mélyebbre ásnak az aktivált komplexumok dinamikájában és szerkezetében. Az ultragyors spektroszkópiai technikák fejlődése lehetővé teheti az aktivált komplexumok valós idejű megfigyelését. Emellett a számítógépes kémia módszereinek finomodása pontosabb előrejelzéseket tehet lehetővé az aktivált komplexumok tulajdonságaira vonatkozóan, ami új utakat nyithat a katalizátorok tervezésében és a kémiai reakciók optimalizálásában.
Az Aktivált Komplexum Ipari Jelentősége
Az aktivált komplexum megértése nem csupán elméleti jelentőséggel bír. Az ipari kémiai folyamatok optimalizálása szempontjából kritikus fontosságú a reakciósebességek szabályozása és a melléktermékek minimalizálása. A katalizátorok hatékony tervezése, amely az aktivált komplexumok stabilizálásán vagy destabilizálásán alapul, jelentős gazdasági és környezetvédelmi előnyökkel járhat.
Példák Aktivált Komplexumok Előfordulására
Számos kémiai reakcióban az aktivált komplexum központi szerepet játszik. Ide tartoznak például az SN1 és SN2 reakciók az organikus kémiában, ahol egy pentakoordinált átmeneti állapot (az aktivált komplexum) alakul ki. Hasonlóképpen, a fémorganikus katalizált reakciók, mint például a Heck-reakció vagy a Suzuki-kapcsolás, is aktivált komplexumokon keresztül mennek végbe, amelyek szerkezetének és energiájának megértése kulcsfontosságú a katalizátor hatékonyságának növeléséhez.
Az Aktivált Komplexum és a Biokémiai Reakciók
A biokémiai reakciók, amelyek az élő szervezetekben zajlanak, szintén aktivált komplexumokon keresztül mennek végbe. Az enzimek, mint biológiai katalizátorok, rendkívül hatékonyan csökkentik a biokémiai reakciók aktiválási energiáját azáltal, hogy stabilizálják az átmeneti állapotot. Az enzim-szubsztrát komplexus kialakulása és az azt követő átmeneti állapot létrejötte kulcsfontosságú lépés az enzimatikus katalízisben.